键能、键长、键角及其应用 知识点题库
①根据N2与CO为等电子体,写出CO分子的电子式.
②试比较两分子中的键角大小:H2ONH3 , (填“>”、“=”或“<”)
③CO2中含有的σ键和π键的数目之比为.


-
(1) 制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下: 
则该反应的ΔH=kJ·mol-1。
-
(2) 上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示: 
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为。
②X轴上a点的数值比b点(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是。
-
(3) 实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2 , 则每生成3 mol PbI2的反应中,转移电子的物质的量为。
-
(4) 常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1 , 则Ksp(PbI2)=;已知Ksp(PbCl2)=1.6×10-5 , 则转化反应PbCl2(s)+2I-(aq)
 PbI2(s)+2Cl-(aq)的平衡常数K=。
PbI2(s)+2Cl-(aq)的平衡常数K=。
-
(5) 分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)
 2HI (g)的ΔH(填大于或小于)0。
2HI (g)的ΔH(填大于或小于)0。②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O
 3H++HSO4-+2I- , I2+I-
3H++HSO4-+2I- , I2+I-  I3- , 图2中曲线a、b分别代表的微粒是、(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是。
I3- , 图2中曲线a、b分别代表的微粒是、(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是。


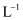 •
•  D . 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D . 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
-
(1) 基态Co原子的价层电子排布图为;金属Co的熔点、沸点均高于金属K的原因为。
-
(2)
 、
、  、
、  的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。
的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。
-
(3) 碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

①冠醚中O原子的杂化形式为;H、C、O的电负性由小到大的顺序为。
②
 不能镶入甲中而易镶入乙中的原因为。
不能镶入甲中而易镶入乙中的原因为。 -
(4)
 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。 ①每个晶胞中由K和F共同形成的正四面体空隙有个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为
 ,晶体密度ρ=
,晶体密度ρ=  。
。
-
(1)
 的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。
的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。
-
(2) Li、O、P三种元素的电负性由大到小的顺序是:。
-
(3) 写出一种与
 互为等电子体的分子的化学式:,该分子的中心原子的价层电子对数等于。
互为等电子体的分子的化学式:,该分子的中心原子的价层电子对数等于。
-
(4) 已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
-
(5) N和P是同主族元素,但是
 分子中的键角大于
分子中的键角大于  分子中的键角,原因是:。
分子中的键角,原因是:。
-
(6)
 为离子晶体,具有反萤石结构,晶胞如下图所示。则
为离子晶体,具有反萤石结构,晶胞如下图所示。则  配位数为:,若晶胞参数为bnm,阿伏加德罗常数的值为
配位数为:,若晶胞参数为bnm,阿伏加德罗常数的值为  ,则
,则  的密度为
的密度为 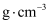 (列出计算式即可)。
(列出计算式即可)。 
-
(1) 基态Ti原子的价层电子排布式为。根据规则可知硅、硼元素一些化学性质相似。
-
(2) NaBH4所含元素中第一电离能最小的是(填元素符号)。
 与NH3的VSEPR模型相似,
与NH3的VSEPR模型相似,  的键角大于NH3的键角的原因是,任意写出一种
的键角大于NH3的键角的原因是,任意写出一种  的等电子体(写粒子符号)。
的等电子体(写粒子符号)。
-
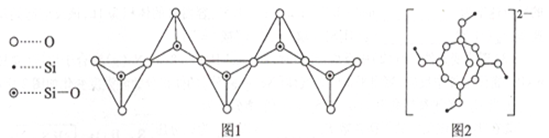
(3) 硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为。
-
(4) 硼砂的构成为Na2[B4O5(OH)4]·8H2O,其阴离子[B4O5(OH)4]2-的结构如图2所示。B的杂化方式为。硼砂中不存在(填标号)。
A.氢键 B.金属键 C.配位键 D.离子键
-
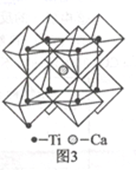
(5) 钙钛矿晶体的结构如图3所示。假设把氧离子看作硬球接触模型,钛离子位于氧离子形成的正八面体中心,钙离子位于立方晶胞的体心。一个钙离子被个氧离子包围。若钛离子与钙离子间最短距离为apm,则氧离子半径为pm。
 ”表示共用电子对,用“
”表示共用电子对,用“  ”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为:则以下叙述错误的是( )
”表示未成键孤对电子的式子叫路易斯结构式.R分子的路易斯结构式可以表示为:则以下叙述错误的是( ) 

-
(1) 氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>。基态K+电子占据最高能级的电子云轮廓图为形。
-
(2) NaBH4是有机合成中常用的还原剂,其中阴离子的键角为。
-
(3) 下列硼原子电子排布图表示的状态中,能量最低和最高的分别为、(填字母标号)。
A.
 B.
B. 
C.
 D.
D. 
-
(4) 硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。

①B2H6分子结构如图,则B原子的杂化方式为。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是,写出一种与氨硼烷互为等电子体的分子(填化学式)。
-
(5) 磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。P的配位数为,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是,已知晶胞边长为apm,则磷化硼晶体的密度是g·cm-3。

-
(1) 一些氧化物的熔点如表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/℃
1570
2800
23.8
-75.5
解释表中氧化物之间熔点差异的原因:。
-
(2) Cr2O
 的结构如图所示。则该离子中σ键与π键的个数比为。
的结构如图所示。则该离子中σ键与π键的个数比为。
-
(3) [Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O的空间结构和相应的键角如图所示。

H2O的键角小于NH3的键角,原因是。
-
(4) 钛某配合物可用于催化环烯烃聚合,其结构如图所示。

该配合物中存在的化学键有____(填字母代号)。
A . 离子键 B . 配位键 C . 金属键 D . 共价键 E . 氢键 -
(5) 已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子的化学式为,阴离子的空间构型为。

-
(6) 已知TiN晶体的晶胞结构如图所示,若该晶胞中Ti原子与N原子的最近距离为apm,阿伏加德罗常数的值为NA , 则晶胞的密度为g·cm-3。[M(TiN)=62g·mol-1 , 用含a、NA的代数式表示]。

|
共价键 |
H-H |
F-F |
H-F |
H-Cl |
H-I |
|
|
436 |
157 |
568 |
432 |
298 |
 B . 表中最稳定的共价键是H-F键
C . 键的极性:
B . 表中最稳定的共价键是H-F键
C . 键的极性: D .
D . 




