分子晶体 知识点题库
已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
-
(1) 比E核外电子数少5的元素的原子核外电子排布式是,A、B、C、D的第一电离能由小到大的顺序为。
-
(2) B的氯化物的熔点远高于C的氯化物的熔点,理由是。
-
(3) A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的空间构型是。
-
(4) A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。

下列说法正确的是( )
A . 分子晶体中一定存在分子间作用力,不一定存在共价键
B . 水加热到很高的温度都难以分解于氢键有关
C . CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D . HF、HCl、HBr、HI的熔沸点随着相对分子质量的增加依次升高
某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于( )
A . 原子晶体
B . 离子晶体
C . 分子晶体
D . 金属晶体
现有下列几种物质:
①CaS ②Ar ③CaO2 ④金刚石 ⑤SiC ⑥H2O2 ⑦(NH4)2SO4⑧MgCl2 ⑨CH3COONa ⑩[Cu(NH3)4]SO4 (以下空格均填写序号)
(1)不含极性键的分子晶体是 ;
(2)含有极性键的分子晶体是 ;
(3)只含离子键的离子晶体是 ;
(4)含有极性键的原子晶体是 ;
(5)含有非极性键的离子晶体是 ;
(6)含有配位键的离子晶体是
科学家最近又发现了一种新能﹣﹣“可燃冰”.它的主要成分是甲烷分子的结晶水合物(CH4•nH2O).其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”.这种“可燃冰”的晶体类型是( )
A . 离子晶体
B . 分子晶体
C . 原子晶体
D . 金属晶体
几种晶体的晶胞如图所示:

所示晶胞从左到右分别表示的物质正确的排序是( )
A . 碘、锌、钠、金刚石
B . 金刚石、锌、碘、钠
C . 钠、锌、碘、金刚石
D . 锌、钠、碘、金刚石
有下列几种晶体:
A.SiC B.CO2 C.水晶 D.白磷 E.晶体氩 F.氯化铵 G.金刚石 H.铁
-
(1) 其中经常用作玻璃刀刀头的是
-
(2) 属于原子晶体的化合物是
-
(3) 含有共价键的离子晶体是
-
(4) 受热熔化后化学键不发生变化的是
-
(5) 熔融状态下能导电的是.
下面的排序错误的是( )
A . 硬度由大到小:金刚石>碳化硅>晶体硅
B . 晶格能由大到小: NaF> NaCl> NaBr>NaI
C . 晶体熔点由低到高:CF4<CCl4<CBr4<CI4
D . 熔点由高到低:Na>Mg>Al
-
(1) 下列物质在固态时,属于分子晶体的有,属于原子晶体的,属于离子晶体的有(以上均填序号)
①金刚石 ②氩 ③水晶 ④水银 ⑤氟化钙 ⑥P4 ⑦苯
-
(2) 某常见固体能导电,质软,它可能属于__________A . 分子晶体 B . 原子晶体 C . 离子晶体 D . 金属晶体 E . 混合晶体
-
(3) 在氯化钠晶体(见图1)中,每个钠离子与个最近且等距离的氯离子以 键相结合,与每个氯离子最近的且等距离的氯离子有 个。由于晶体中离子按一定的规律排列,必然造就了一颗完美晶体特定的几何外形,其中氯化钠单晶的宏观外形为 。

下列说法正确的是( )
A . Na2O与Na2O2所含的化学键类型完全相同
B . 离子晶体中一定存在共价键
C . 分子晶体中共价键键能越大,该分子晶体的熔沸点越高
D . 石墨晶体中有共价键、范德华力、金属键等几种电性作用
砷化镓是一种重要的半导体材料,熔点1238 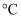 。它在600
。它在600 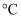 以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
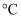 。它在600
。它在600 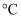 以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( ) 
A . 砷化镓是一种分子晶体
B . 砷化镓中不存在配位键
C . 晶胞中Ga原子与As原子的数量比为4:1
D . 晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
下列有关晶体的叙述符合题意且前后叙述有因果关系的是( )
A .  晶体熔点高、硬度大;
晶体熔点高、硬度大;  晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中
晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中  与
与  个数比为1:1,CsCl晶体中
个数比为1:1,CsCl晶体中  与
与  个数比也为1∶1,NaCl和CsCl的晶胞结构相同
个数比也为1∶1,NaCl和CsCl的晶胞结构相同
 晶体熔点高、硬度大;
晶体熔点高、硬度大;  晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中
晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中  与
与  个数比为1:1,CsCl晶体中
个数比为1:1,CsCl晶体中  与
与  个数比也为1∶1,NaCl和CsCl的晶胞结构相同
个数比也为1∶1,NaCl和CsCl的晶胞结构相同
-
(1) 写出
 的电子式:。
的电子式:。
-
(2) 二氧化硅熔化需1723℃,而干冰升华在常温下就可以进行,解释前者比后者所需温度高很多的原因:。
-
(3) 已知:
 比
比  易电离出
易电离出  。请用一个离子方程式证明:。
。请用一个离子方程式证明:。
下列说法正确的是( )
A . H2O2中的氧原子满足最外层8电子稳定结构
B . 葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体
C . Na2O2溶于水只需克服离子键
D . HF比HCl稳定,是由于HF分子间存在氢键
分子晶体具有的本质特征是( )
A . 晶体硬度小
B . 熔融时不导电
C . 晶体内微粒间以分子间作用力相结合
D . 熔点一般比共价晶体低
有关晶体的结构如图所示,下列说法中错误的是( )
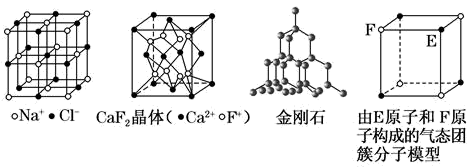
A . 在 晶体中,距
晶体中,距 最近的
最近的 有6个,距
有6个,距 最近且等距的
最近且等距的 共12个
B . 在
共12个
B . 在 晶体中,每个晶胞平均占有4个
晶体中,每个晶胞平均占有4个 ,
,  的配位数是4
C . 在金刚石晶体中,每个碳原子被12个六元环共同占有,每个六元环最多有4个碳原子共面
D . 该气态团簇分子的分子式为
的配位数是4
C . 在金刚石晶体中,每个碳原子被12个六元环共同占有,每个六元环最多有4个碳原子共面
D . 该气态团簇分子的分子式为 或
或 , 其晶体不导电
, 其晶体不导电
 晶体中,距
晶体中,距 最近的
最近的 有6个,距
有6个,距 最近且等距的
最近且等距的 共12个
B . 在
共12个
B . 在 晶体中,每个晶胞平均占有4个
晶体中,每个晶胞平均占有4个 ,
,  的配位数是4
C . 在金刚石晶体中,每个碳原子被12个六元环共同占有,每个六元环最多有4个碳原子共面
D . 该气态团簇分子的分子式为
的配位数是4
C . 在金刚石晶体中,每个碳原子被12个六元环共同占有,每个六元环最多有4个碳原子共面
D . 该气态团簇分子的分子式为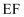 或
或 , 其晶体不导电
, 其晶体不导电
以NA表示阿伏加德罗常数的值,下列说法正确的是 ( )


A . 18 g冰(图1)中含氢键数目为4NA
B . 28 g晶体硅(图2)中含有Si-Si键数目为4NA
C . 88 g干冰(图3)中含有0.5NA个晶胞结构单元
D . 12 g石墨烯中含C-C键数目为3NA
下列关于晶体的描述中,正确的是( )
A . 碘晶体升华时破坏了共价键
B . 分子晶体中分子间作用力越大,分子越稳定
C . 用X射线衍射实验可以区分晶体和非晶体
D . 氯化钠和铁融化时克服的粒子间作用力是同种类型
下列关于晶体的叙述正确的是( )
A . 晶体中只要有阳离子就一定有阴离子
B . 区分晶体和非晶体最可靠的方法是对固体进行X射线衍射实验
C . 分子晶体中共价键键能越大熔点和沸点越高
D . 金属晶体发生形变时,内部金属离子与“自由电子”的相互作用消失
下列关于化学键的说法中错误的是( )
A . 化学键分为离子键、共价键、氢键等
B . 相邻的阳离子和阴离子之间强烈的相互作用称为离子键
C . 干冰晶体中存在共价键和分子间作用力
D . 金刚石晶体中只存在共价键,不存在分子间作用力
最近更新



