晶体熔沸点的比较 知识点
比较办法:1、原子晶体比较键能和键长,一般键长越短,键能就越大,熔沸点就越高 。2、离子晶体组成晶体的离子半径越小,融沸点越高。3、分子晶体比较分子间作用力,单质的相对分子质量越大,分子间作用力越大,熔沸点越高。但要注意氢键。4、金属晶体一般只要知道融沸点固体大于液体大于气体。5、金属和离子晶体还可比较键焓,键焓等于一个常数与离子或原子团所带电荷数的乘积再比上核间距的平方,键焓越大,熔沸点越高。
晶体熔沸点的比较 知识点题库
晶体 | NaCl | KCl | CaO |
晶格能/(Kj.mol﹣1) | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 .
(2)已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=﹣641Kj.mol﹣1
②Ti(s)+2Cl2(g)=TiCl4(g)△H=﹣770kJ.mol﹣1
则固体镁和四氯化钛气体反应的热化学方程式是
(3)在压强为0.1MPa条件下,将CO与H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),该反应的△H 0,△s 0(填“<”、“>”或“=”).
-
(1) Ni在元素周期表中的位置是,其价电子层中有个未成对电子。
-
(2) 镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是。
②其分子中σ键与π键数目之比为。
③写出一种与配体CO互为等电子体的阴离子符号。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有种。
-
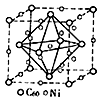
(3) 金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为。
-
(4) NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+ , 晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为;若阿伏加德罗常数的值为NA , 晶体密度为d g·cm-3 , 则该晶胞中最近的O2-之间的距离为pm。
原子晶体 | 金刚石 | 氮化硼 | 碳化硅 | 石英 | 硅 | 锗 |
熔点/℃ | 3 900 | 3 000 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 9.5 | 7 | 6.5 | 6.0 |
①构成原子晶体的原子种类越多,晶体的熔点越高
②构成原子晶体的原子间的共价键的键能越大,晶体的熔点越高
③构成原子晶体的原子半径越大,晶体的硬度越大
④构成原子晶体的原子半径越小,晶体的硬度越大
| 选项 | 实验事实 | 理论解释 |
| A | 碘单质在 CCl4 中溶解度比在水中大 | CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子 |
| B | CO2 为直线形分子 | CO2 分子中 C═O 是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF 的沸点高于 HCl | HF 的相对分子质量小于 HCl |
-
(1) 硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是
-
(2) 基态硅的价电子排布式为,其核外电子的运动状态有种。
-
(3) CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为。
-
(4) SiF4的热稳定性比SiCl4强的原因是 。
-
(5) 碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为,若晶体的密度为ρg/cm3
 ,阿伏加德罗常数为NA , 则距离最近的Si原子与C原子之间的距离为cm。(用ρ和NA的式子表示)
,阿伏加德罗常数为NA , 则距离最近的Si原子与C原子之间的距离为cm。(用ρ和NA的式子表示) 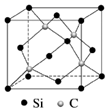

-
(1) 用“>”、“<”或“=”填写下列空格:
①熔点:金刚石SiC
②键角:NH3CH4
③原子的核外电子排布中,未成对电子数:


④A、B元素的价电子排布分别为3d104s1、3d84s2 , 第二电离能:AB
-
(2) 已知四氯化铅主要用于有机盐合成,其熔点为-15℃,沸点为50℃,则PbCl4晶体类型为,空间构型为。
-
(3) SiO2晶体结构片段如下图1所示。SiO2晶体中:Si原子数目和Si-O键数目的比例为。某氧化亚铁晶体的晶胞如图2所示,与Fe2+紧邻且等距离的Fe2+数目为。
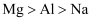 B .
B . 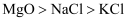 C . 晶体硅>金刚石>碳化硅
D .
C . 晶体硅>金刚石>碳化硅
D . 
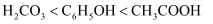 B . 碱性:
B . 碱性: 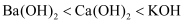 C . 熔点:
C . 熔点: 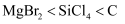 (金刚石)
D . 沸点:
(金刚石)
D . 沸点: 
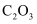 是一种无色无味的气体,结构式如图,可溶于水生成草酸:
是一种无色无味的气体,结构式如图,可溶于水生成草酸: 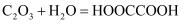 。下列说法正确的是( )
。下列说法正确的是( ) 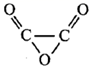
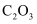 是非极性分子
C . 晶体熔点:草酸>冰>三氧化二碳>干冰
D .
是非极性分子
C . 晶体熔点:草酸>冰>三氧化二碳>干冰
D .  、
、 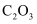 和
和 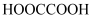 分子中碳原子的杂化方式均相同
分子中碳原子的杂化方式均相同
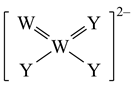
-
(1) Z在周期表中的位置是,第七周期与Z同族元素的原子序数为。
-
(2) Z、W、R离子半径由大到小顺序为(用化学式表示)。
-
(3) 用电子式表示X与R组成的物质的形成过程。
-
(4) Y、W的简单氢化物沸点较高的是(填化学式),判断依据是。
-
(5) 写出图中离子与稀硫酸反应的离子方程式。
-
(1) 用质谱仪检测氟化氢气体时,谱图中出现质荷比(相对分子质量)为40的峰,原因是。
-
(2)
 的熔点(2054℃)比
的熔点(2054℃)比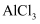 (190℃)熔点高很多的原因是。
(190℃)熔点高很多的原因是。
-
(1) 我们知道,水在4℃时密度最大,请结合物质结构与性质的知识做出解释:。
-
(2) 硅和卤素单质反应可以得到
 ,
,  的熔、沸点如下表:
的熔、沸点如下表:



熔点/K
183
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
 、
、 、
、 、
、 沸点依次升高的原因是。
沸点依次升高的原因是。
化合物(相对分子质量) | 沸点/℃ | 化合物(相对分子质量) | 沸点/℃ |
甲醇(32) | 64.7 | 乙烷(30) | -88.6 |
乙醇(46) | 78.3 | 丙烷(44) | -42.1 |
正丙醇(60) | 97.2 | 正丁烷(58) | -0.5 |
正丁醇(74) | 117.9 | 正戊烷(72) | 36.1 |
-
(1) 基态Ga原子的价电子排布式为。
-
(2) 晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为。
-
(3) 氮化镓不存在于自然界中,只能通过人工合成来制备,反应为
 。
。①GaCl3熔点为77.9℃,其晶体类型为。GaF3的熔点为1000℃,则将GaF3熔化时,被破坏的作用力是。
②上述反应涉及的元素中,电负性最小的是(填元素符号,下同),第一电离能最大的是。
-
(1) 基态Ti原子的价层电子轨道表示式为。
-
(2) 在TiO、TiN、TiS2、TiCl4等化合物中,S、C的电负性大小:S(填“>”“<”或“=”)Cl。O、N的第一电离能大小为O<N,原因是。
-
(3) TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4 , 该晶体是晶体。
-
(4) TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为。SO
 阴离子S中硫原子的杂化方式为 。
阴离子S中硫原子的杂化方式为 。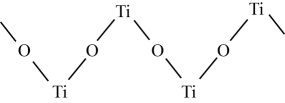
-
(5) 如图是钛晶体在空间的一种堆积方式,钛原子的配位数为, 已知:a=0. 295 nm,c=0. 469 nm,则该钛晶体的密度为g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
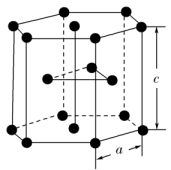
-
(1) NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2 , 该反应离子方程式。
-
(2) NH3·H2O的电离方程式为NH3·H2O
 NH4++OH- , 试判断溶于水后,形成的合理结构是。(填图中的字母)
NH4++OH- , 试判断溶于水后,形成的合理结构是。(填图中的字母)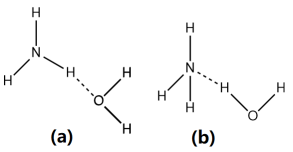
-
(3) 把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+ , 此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl,CoCl3·5NH3中Co化合价为,请写出表示此配合物结构的化学式:。
-
(4) H2O、H2S、H2Se熔沸点由低到高的顺序:。
-
(5) HF比HCl热稳定性(填“强”或“弱”),原因是:。



