晶体熔沸点的比较 知识点题库
SiCl4的分子结构与CCl4类似,对其作出如下推断,其中正确的是( )
①SiCl4晶体是分子晶体 ②常温、常压SiCl4是液体 ③SiCl4的分子是由极性键形成的非极性分子 ④SiCl4熔点高于CCl4
①SiCl4晶体是分子晶体 ②常温、常压SiCl4是液体 ③SiCl4的分子是由极性键形成的非极性分子 ④SiCl4熔点高于CCl4
A . 只有①
B . 只有①②
C . 只有②③
D . 全部
各组性质比较的表示中,正确的是 ( )。
A . 酸性:HI < HBr < HCl < HF
B . 稳定性:HF< HCl < HBr < HI
C . 氧化性:F2 < Cl2 < Br2 < I2
D . 沸点:F2 < Cl2 < Br2 < I2
下列有机化合物中沸点最高的是( )
A . 乙烷
B . 乙烯
C . 乙醇
D . 乙酸
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:( )
烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
沸点(℃) | ﹣88.6 | ﹣42.1 | ﹣0.5 | 36.1 |
*燃烧热(kJ•mol﹣1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
*燃烧热:1mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量.根据表中数据,下列判断错误的是( )
A . 正庚烷在常温常压下肯定不是气体
B . 直链烷烃燃烧热和其所含碳原子数呈线性关系
C . 随碳原子数增加,直链烷烃沸点逐渐升高
D . 随碳原子数增加,直链烷烃沸点和燃烧热都成比例增加
在1﹣18号元素中,部分连号元素单质的熔点情况如图所示,试回答:
(1)c点代表的单质可以是 ,其熔点高的主要原因是 .
(2)d所属的晶体类型是

图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )

A . H2S
B . CH4
C . PH3
D . SiH4
下列关于物质熔点的排列顺序,不正确的是( )
A . HI>HBr>HCl>HF
B . CI4>CBr4>CCl4>CF4
C . NaCl>NaBr>KBr
D . 金刚石>碳化硅>晶体硅
下列物质的熔点高低顺序,正确的是( )
A . 金刚石>晶体硅>碳化硅
B . K>Na
C . HCHO<CH3OH
D . NaF<NaCl<NaBr
下面的排序错误的是( )
A . 空间利用率:Cu>Na>Po
B . 熔点由高到低:金刚石>NaCl>K>CO2
C . 硬度由大到小:SiC>金刚石
D . 晶格能由大到小:NaF>NaCl>NaBr
Mg和SiO2在高温下反应生成MgO和Mg2Si。下列说法正确的是( )
A . 物质的熔点:Mg>MgO
B . 氧元素不存在同素异形体
C . Mg的还原性强于Si
D . 该反应是置换反应,镁元素被氧化
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
-
(1) 写出基态As 原子的核外电子排布式。
-
(2) 根据元素周期律,原子半径 GaAs(填“>”或“<”,下同),第一电离能 GaAs。
-
(3) AsCl3 分子的立体构型为。
-
(4) 锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因。
GeCl4
GeBr4
GeI4
熔点/℃
−49.5
26
146
沸点/℃
83.1
186
约 400
德国科学家发现新配方:他使用了远古地球上存在的O2、N2、CH3、NH3、H2O和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法正确的是( )
A . 基态Fe3+价电子排布为:3d5
B . O2、N2、HCN中均存在σ键和π键
C . CH4、NH3、H2O分子间均存在氢键
D . 沸点:C2H5SH(乙硫醇)>C2H5OH
过渡金属硫族化合物  为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。
为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。  的其中一种制备方法是以CuS、ZnS、
的其中一种制备方法是以CuS、ZnS、  和Cu为原料高能球磨后,在
和Cu为原料高能球磨后,在  气氛中退火。回答下列问题:
气氛中退火。回答下列问题:
 为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。
为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。  的其中一种制备方法是以CuS、ZnS、
的其中一种制备方法是以CuS、ZnS、  和Cu为原料高能球磨后,在
和Cu为原料高能球磨后,在  气氛中退火。回答下列问题:
气氛中退火。回答下列问题:
-
(1) 所给电子排布图中,能表示基态S原子3p轨道电子状态的是_______(填标号)。A .
 B .
B .  C .
C .  D .
D . 
-
(2) 基态
 的价层电子排布式是。
的价层电子排布式是。
-
(3) CuS由
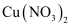 与
与  反应制备。根据价层电子对互斥模型,
反应制备。根据价层电子对互斥模型,  中心原子价层电子对数为。
中心原子价层电子对数为。  的空间构型为。
的空间构型为。
-
(4)
 的晶体类型与CuS相同,除上述用途外,
的晶体类型与CuS相同,除上述用途外,  也用于制作火柴头。火柴燃烧时,
也用于制作火柴头。火柴燃烧时,  转化为
转化为  和
和  ,这三种物质熔点由高到低的顺序是。
,这三种物质熔点由高到低的顺序是。
-
(5)
 的四方晶胞如图所示。
的四方晶胞如图所示。 
①Sb位于晶胞的顶点和体心,则图中A代表的原子是。
②原子A的坐标为
 ,原子B的坐标为
,原子B的坐标为  ,则原子C的坐标为。
,则原子C的坐标为。③设阿伏加德罗常数的值为
 ,则
,则  的密度为
的密度为 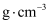 (列出计算表达式)。
(列出计算表达式)。
在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。
-
(1) 铁离子的价层电子排布图为。
-
(2) 碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是。
-
(3) 1mol 苯分子中含有σ键的数目为。
-
(4) 6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是。


-
(5) 铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式。
-
(6) 晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(-
 ,-
,-  ,0);B处为(0,0,0);则C处微粒的坐标参数为。
,0);B处为(0,0,0);则C处微粒的坐标参数为。
②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为g·cm-3 , (NA为阿伏加德罗常数的值,用含a、NA的式子表示)。
填空。
-
(1) 相同温度下,等浓度的苯酚水溶液酸性(填“强于”“弱于”“等于”)乙醇水溶液,原因是:
-
(2) 已知物质的熔点对比如表:
物质
熔点/℃
物质
熔点/℃

672
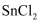
247

306

-33
 的熔点低于
的熔点低于 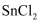 的沸点原因是:
的沸点原因是:
回答下列问题:
-
(1) 已知三种晶体的熔点数据如表:
化合物
Mg3N2
AlN
Si3N4
熔点
800℃
2249℃
1800℃以上
氮化铝的熔点明显高于Mg3N2的原因是。
-
(2) NaHS2是离子化合物,写出其电子式:。
-
(3)
 常温下微溶于水而CH3CH2OH常温下与水任意比互溶,试分析可能原因:。
常温下微溶于水而CH3CH2OH常温下与水任意比互溶,试分析可能原因:。
下列说法正确的是( )
A . 分子式相同,各元素质量分数也相同的物质是同种物质
B . 护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的石蜡,其主要成分都是含碳原子数较多的烷烃
C . 烷烃热稳定性很好,在较高温度下也不会分解
D . 正丁烷的沸点比异丁烷的沸点低
氟代硼铍酸钾晶体(KBe2BO3F2)用于制造深紫外固体激光器,在国防安全、信息技术等领域有重大战略价值。上世纪90年代初,中科院院士陈创天的研究团队在国际上首先生产出大尺寸氟代硼铍酸钾晶体。实验室可用BeO、KBF4和B2O3在700℃左右灼烧获得氟代硼铍酸钾多晶料(晶胞如图所示,氧原子略去,钾原子已给出),并放出BF3气体。

回答下列问题:
-
(1) 一群处于激发态1s22s13s1的铍原子,在回到基态的过程中,最多可发出种不同波长的光。
-
(2) 组成氟代硼铍酸钾晶体的元素中,第一电离能最小的是(填元素符号,下同),电负性最大的是。
-
(3) 写出生成氟代硼铍酸钾晶体的化学方程式。
-
(4) Be和B都容易与配体形成配位键,如[BeF4]2-、[B(OH)4] - , 从原子结构分析其原因是,上述离子中Be原子和B原子的杂化类型为。
-
(5) 氟硼酸钾(KBF4)在高温下分解为KF和BF3 , KF的沸点远高于BF3的原因是。
-
(6) 图中代表硼原子的字母为,该晶胞参数分别为a pm和c pm,α=β= γ=90°,则晶体密度为g·cm-3(NA表示阿伏加德罗常数的值,列出计算式)。
科学家利用四种原子序数依次增大的短周期主族元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构示意图如下(注:实线代表共价键,其他重复单元的W、X未标注)。已知X、Y位于同一周期,基态Z原子中只有两种形状的电子云,最外层只有一种自旋方向的电子,下列说法正确的是( )

A . 氢化物的沸点: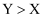 B . Y与Z形成的化合物中只含离子键
C . 由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体
D . 该超分子反映了超分子“分子识别”的特性
B . Y与Z形成的化合物中只含离子键
C . 由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体
D . 该超分子反映了超分子“分子识别”的特性
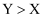 B . Y与Z形成的化合物中只含离子键
C . 由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体
D . 该超分子反映了超分子“分子识别”的特性
B . Y与Z形成的化合物中只含离子键
C . 由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体
D . 该超分子反映了超分子“分子识别”的特性
早在1914年就有人发现,引入有机基团可降低离子化合物的熔点,如 的熔点只有12℃,比
的熔点只有12℃,比 的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
 的熔点只有12℃,比
的熔点只有12℃,比 的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。

-
(1) 1-乙基-3甲基咪唑四氟硼酸盐中涉及的元素除氢元素外,其余元素均位于元素周期表的区,基态F原子核外电子的运动状态有种。
-
(2)
 极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合
极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合 的电离推测
的电离推测 可能的结构式为。
可能的结构式为。
-
(3) 硅元素与碳元素同主族,硅元素和卤素单质反应可以得到
 。
。
 的熔沸点如下表所示
的熔沸点如下表所示
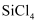


熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
20℃时,
 、
、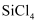 、
、 、
、 呈液态的是(填化学式),熔沸点依次升高的原因是。
呈液态的是(填化学式),熔沸点依次升高的原因是。 -
(4) 下列有关该离子液体说法正确的是____。A . 该离子液体的阳离子中C原子和N原子的杂化轨道类型均为
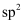 、
、 B . 离子液体中C、N、H三种元素的电负性由大到小的顺序为
B . 离子液体中C、N、H三种元素的电负性由大到小的顺序为 C . 该离子液体的熔沸点低于氯化钠晶体,是因为阴阳离子体积较大,使得阴阳离子间距离较大,离子键较弱
D . 离子液体中微粒间作用力较大,一般比有机溶剂难挥发,是很好的“绿色”溶剂
C . 该离子液体的熔沸点低于氯化钠晶体,是因为阴阳离子体积较大,使得阴阳离子间距离较大,离子键较弱
D . 离子液体中微粒间作用力较大,一般比有机溶剂难挥发,是很好的“绿色”溶剂
最近更新



