含有氢键的物质 知识点题库
①根据这一规律高氯酸是很强的酸
②H3PO4的酸性比盐酸的酸性强
③碳酸和亚硫酸的酸性不好比较
④硝酸与磷酸的酸性强度一样
 的沸点比
的沸点比 高,原因是 .碳、硅元素的单质及其化合物是构成自然界的重要物质.
高,原因是 .碳、硅元素的单质及其化合物是构成自然界的重要物质.(2)甲硅烷(SiH4)的结构与甲烷相似.SiH4分子中Si﹣H为 (σ键或π键);甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2H2O═8Ag↓+SiO2↓+8HNO3 , 该反应中氢元素被氧化,则SiH4充当 剂(填氧化或还原),由此可判断电负性:Si H(填“>”、“<”或“=”)
-
(1) 某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图,该元素基态原子结构示意图.该元素的名称为,形成的单质为晶体.
-
(2) 指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、.
-
(3) 试比较下列含氧酸的酸性强弱:H3PO4H3PO3(填“>”、“<”或“=”).
-
(4) 根据价层电子对互斥理论判断:NH3的电子式为中心原子的杂化方式为
杂化,VSEPR构型为,分子的立体构型为.
-
(5) 在下列物质①CO2、②NH3、③CCl4、④C2H2、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号).
-
(6) H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于.
-
(1) Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为。
-
(2) 亚氨基锂(Li2NH) 所含元素第一电离能最小的是 ,电负性最大的是 (填元素符号)。
-
(3) 咔唑(
 )的沸点比芴(
)的沸点比芴(  )高的主要原因是。
)高的主要原因是。
-
(4) ①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为。其中B的杂化类型为,可通过测定该分子的立体构型。
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4H2O (填“> "或“<"),原因是。
-
(5) MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①Mg2+的半径为72pm,则H+的半径为pm (列出计算表达式)
②用NA表示阿伏加德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的倍(列出计算表达式,氢气密度为0.089g·L-1)。
①离子化合物中一定含有离子键;②含有共价键的化合物一定是共价化合物;③非金属单质分子中一定含有非极性共价键;④分子间作用力比化学键弱得多;⑤含有离子键的化合物中一定含有金属元素;⑥氢键不是化学键;⑦不同元素组成的多原子分子中的化学键一定都是极性键
 在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol
在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol  的水溶液中加入足量
的水溶液中加入足量  溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为
溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为  ,则
,则  分子间也是因氢键而聚合形成
分子间也是因氢键而聚合形成 
 替换可燃冰(
替换可燃冰(  )中
)中  的设想,替换过程如图所示,下列说法正确的是( )
的设想,替换过程如图所示,下列说法正确的是( ) 
 ,F代表
,F代表  B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
-
(1) 下列铁的外围电子排布图中,再失去一个电子需要能量最大的是(填标号)。
A.
 B.
B. 
C.
 D.
D. 
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为(填元素符号)。
-
(2) 甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
①(H2NCH2COO)2Fe中含有第二周期元素的第一电离能由大到小的顺序为(用元素符号表示),碳原子的杂化类型为。
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃大很多,原因是。
-
(3) 硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁,SO
 的空间构型为,二聚体氯化铁分子结构对称,试写出二聚体氯化铁分子的结构。
的空间构型为,二聚体氯化铁分子结构对称,试写出二聚体氯化铁分子的结构。
-
(4) 铁与镁组成的其中一种储氢合金的晶胞结构如图所示(晶胞的边长为dnm)。
①晶胞中铁原子的配位数为。
②图中a处原子的坐标参数为,合金的密度为g•cm-3。


 的中心原子均为sp3杂化
C . C2H2分子中σ键与π键的数目之比为3:2
D . 水加热到很高温度都难分解是因为水分子间存在氢键
的中心原子均为sp3杂化
C . C2H2分子中σ键与π键的数目之比为3:2
D . 水加热到很高温度都难分解是因为水分子间存在氢键
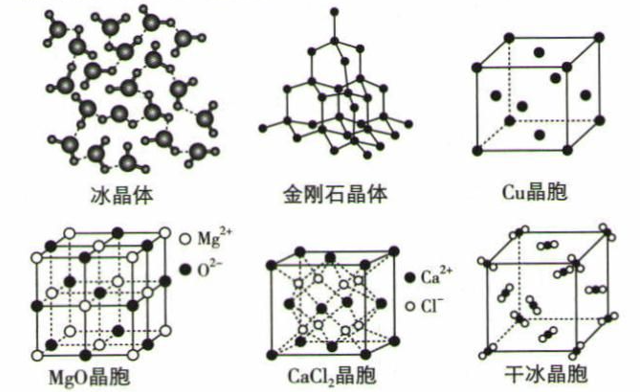
请回答下列问题:
-
(1) 上述晶体中,粒子之间以共价键结合形成晶体的是 。
-
(2) 冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为。
-
(3) NaCl晶胞与MgO晶胞的结构相同,NaCl晶体的晶格能(填“>”或“<")MgO晶体,原因是。
-
(4) 每个Cu晶胞中实际占有个Cu原子;CaCl2晶体中Ca2+的配位数为 。
-
(5) 冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是。
2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
-
(1) 基态F原子的价电子排布图(轨道表示式)为。
-
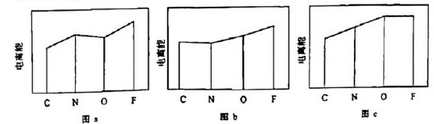
(2) 图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号),判断的根据是;第三电离能的变化图是(填标号)。
-
(3) 固态氟化氢中存在(HF)a形式,画出(HF)3的链状结构。
-
(4) CH2=CH2和ETEFE分子中C的杂化轨道类型分别为和;聚四氟乙烯的化学稳定性高于聚乙烯,从化学健的角度解释原因。
-
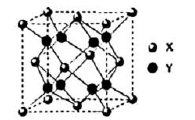
(5) 萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是;若该立方晶胞参数为apm,正负离子的核间距最小为pm。