含有氢键的物质 知识点题库
下列事实与氢键有关的是( )
A . 水结成冰体积膨胀,密度变小
B . 水加热到很高的温度都难以分解
C . CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D . HF、HCl、HBr、HI的热稳定性依次减弱
下列几种氢键:①O﹣H…O,②N﹣H…N,③F﹣H…F,④O﹣H…N,其强度由强到弱的排列顺序是( )
A . ③①④②
B . ①②③④
C . ③②①④
D . ①④③②
图是两种具有相同分子式的有机物﹣﹣邻羟基苯甲酸和对羟基苯甲酸的结构简式.已知它们的沸点相差很大,你认为哪一种沸点较高?如何从氢键的角度来解释?

共价键、离子键、分子间作用力都是微粒间的作用力,下列物质中含有以上两种作用力的晶体是( )
A . SiO2
B . CCl4
C . NaCl
D . NA0H
下列变化或事实与范德华力无关的是( )
A . 气体物质加压或降温时能凝结或凝固
B . 碘溶于四氯化碳
C . 氟、氯、溴、碘单质的熔沸点依次升高
D . 食盐熔化
氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为 .  的沸点比
的沸点比 高,原因是
高,原因是
(3)H+可与H2O形成H3O+ , H3O+原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为
下列说法正确的是( )
A . 在乙醇分子间,既存在分子间作用力又存在氢键
B . 带相反电荷离子之间的相互吸引称为离子键
C . 同素异形体间的相互转化属于物理变化
D . H2O比H2S稳定,因为水分子间有氢键
日前中国量子物质科学协同创新中心的江颖课题组和王恩哥课题组合作,在水科学领域取得重大突破,在国际上首次实现了水分子的亚分子级分辨成像,使得解析水的氢键网络构型成为可能.(图a是实验器件示意图,图b是拍摄到的图片的一部分,图c是图b所对应的结构示意图)下列有关说法不正确的是( )

A . 图a所示实验器件中,用氯化钠作为绝缘薄膜层,是因为氯化钠晶体不导电
B . 图b是表示一个H2O分子内部的氢键和氢氧共价键结构特征示意图
C . 水分子间形成氢键使水的熔点和沸点升高
D . H2O分子的稳定性很强,是因为分子内氢氧共价键强
科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
A . 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致
B . 暖冰中水分子的各原子均满足8电子稳定结构
C . 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
D . 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
根据所学知识填空:
-
(1) 在①CO2 , ②NaCl,③Na,④Si,⑤CS2 , ⑥金刚石,⑦(NH4)2SO4 , ⑧乙醇中,由极性键形成的非极性分子有(填序号,以下同),含有金属离子的物质是,分子间可形成氢键的物质是,属于离子晶体的是,属于原子晶体的是,①~⑤五种物质的熔点由高到低的顺序是
-
(2) A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2 , 不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A.;B.;C.;D..
-
(3) 下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:

A.;B.;C.;D..
磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
-
(1) 画出基态P 原子的核外电子排布图。
-
(2) NH3比PH3 易液化的原因是。
-
(3) P4S3可用于制造火柴,其结构如图1所示。

①P4S3中硫原子的杂化轨道类型为。
②电负性: 磷硫(填“>”或“<”);第一电离能磷大于硫的原因是。
-
(4) NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有mol 配位键。
-
(5) NF3的键角小于NH3的键角,其原因是。
-
(6) 磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1,
 ,
,  ),则b点的原子坐标参数为;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
-
(1) 比较电离出H+能力的相对强弱:HCO
 C6H5OH(填“>” 、“<”或“=”);用一个化学方程式说明上述强弱关系。
C6H5OH(填“>” 、“<”或“=”);用一个化学方程式说明上述强弱关系。
-
(2) CaC2是离子化合物,各原子均满足8电子稳定结构。写出CaC2的电子式。
-
(3) 根据氨水的性质,判断下图中氢键表示正确的是_________。A .
 B .
B . 
氮原子不但可以形成离子键,还可以形成σ键、π键、大π键和配位键等,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
-
(1) 电负性:NO(填“>” 或“<”),基态氮原子价电子排布图不是
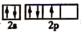 ,是因为该排布方式违背了。
,是因为该排布方式违背了。
-
(2) 肼(H2N-NH2)分子中孤电子对与σ键的数目之比为,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。
-
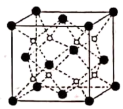
(3) 正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①写出与Na3NO4的阴离子互为等电子体的一种阴离子:(填化学式)。
②在573K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4 , Na2O的立方晶胞如图所示。Na2O晶胞的参数为a pm,则晶胞密度为g/cm3(列出计算式即可,NA为阿伏加德罗常数的值)。
《ChemicalReviews》最近报道了一些化学物质,如价格比黄金还贵的18O2、爆炸力极强的 N5、太空中的乙醇气团、海洋中的新型能源可燃冰等。下列说法中,正确的是( )
A . 18O2和16O2是两种不同的核素
B . N5和 N2互为同素异形体,它们之间的转化属于物理变化
C . 乙醇是一种可再生能源,乙醇的燃烧属于放热反应
D . 可燃冰(CH4•8H2O)中甲烷分子与水分子之间可形成氢键
中科院国家纳米科学中心科研员在国际上首次“拍"到氢键的“照片”,实现了氢键的空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键说法中错误的是( )
A . 由于氢键的存在,冰能浮在水面上
B . 由于氢键的存在,乙醇比甲醚更易溶于水
C . 由于氢键的存在,沸点:HF>HCl>HBr>HI
D . 由于氢键的存在,影响了蛋白质分子独特的结构
回答下列问题:
-
(1) 已知固态NH3、H2O、HF中的氢键的键能和结构示意图如表所示:
物质及其氢健
HF(s):F—H…F
H2O(s):O—H…O
NH3(s):N—H…N
健能/(kJ·mol-1)
28.1
18.8
5.4

H2O、HF、NH3沸点依次降低的原因是。
-
(2) 镓的卤化物熔点如表所示:
物质
GaF3
GaCl3
GaBr3
GaI3
熔点/℃
1000
78
124
213
各物质的熔点从GaCl3、GaBr3、GaI3到GaF3依次升高,原因是。
 可写
可写  ,其结构示意图如下:
,其结构示意图如下: 
下列有关  的说法正确的是( )
的说法正确的是( )
A .  俗称绿矾
B . 氧原子参与形成配位键和氢键两种化学键
C .
俗称绿矾
B . 氧原子参与形成配位键和氢键两种化学键
C .  的价电子排布式为
的价电子排布式为  D . 胆矾中的水在不同温度下会分步失去
D . 胆矾中的水在不同温度下会分步失去
 俗称绿矾
B . 氧原子参与形成配位键和氢键两种化学键
C .
俗称绿矾
B . 氧原子参与形成配位键和氢键两种化学键
C .  的价电子排布式为
的价电子排布式为  D . 胆矾中的水在不同温度下会分步失去
D . 胆矾中的水在不同温度下会分步失去
下列说法错误的是( )
A . 分子晶体中分子间作用力越大,该物质化学性质越稳定
B . 利用质谱图能获得有机化合物的相对分子质量
C . 缺角的氯化钠晶体能在饱和NaCl溶液中慢慢变为完美的立方体块
D . 冰晶体中每个水分子与另外四个水分子形成氢键,且四个水分子形成四面体结构
下列有关说法错误的是( )
A . 羊毛织品水洗后变形与氢键的变化有关
B . 酚醛树脂的单体是苯酚和甲醛
C . 茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D . 丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
下列变化或数据与氢键无关的是( )
A . 甲酸蒸气的密度在373K时为1.335g·L-1 , 在293K时为2.5 g·L-1
B . 氨分子与水分子形成一水合氨
C . 水结冰体积增大。
D . SbH3的沸点比PH3高
最近更新



