有关范围讨论题的计算 知识点题库
x的取值 | 固体成分 | 气体成分 | |
A | 0<x<1/2 | Na2CO3 | H2O(g)、O2、CO2 |
B | x=1/2 | Na2CO3 | H2O(g)、O2 |
C | 1/2<x≤1 | Na2CO3、NaOH | H2O(g)、O2 |
D | x>1 | Na2CO3、NaOH、Na2O2 | O2 |
-
(1) 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是 (填化学式),反应中若产生0.3mol的气体则有 mol的电子转移.
-
(2) a+b的最大值为 , a+b最小值为
(2)现有以下物质:①NaCl晶体 ②干冰 ③稀醋酸 ④汞 ⑤蔗糖(C12H22O11) ⑥冰醋酸请回答下列问题(用序号):以上物质中能导电的是 ;以上物质中属于电解质的是 .
(3)已知:2Fe3++2I﹣=2Fe2++I2; 2Fe2++Br2=2Fe3++2Br﹣
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2 , 此时被氧化的离子是 .
②如果向①的溶液中通入3mol Cl2 , 则被氧化的离子对应的氧化产物分别是 .
(4)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m:n=1:2.7,该反应的化学方程式为 (假设还原产物只有一种,且只生成一种盐).
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4gHNO3被还原成NO(无其它还原产物)则 n 的范围为 .
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是 .
-
(1) 当 a=1,消耗的氧气为 mol
-
(2) 当 a=1 时,乙烯与乙烷的物质的量之比 n(C2H4):n(C2H6)=
-
(3) a 的取值范围是.
| 海水密度 (g·mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
当海水密度达到1.21~1.22 g·mL-1时,析出的盐中,质量分数最大的是( )
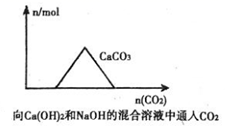 B .
B . 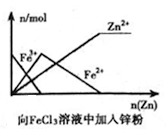 C .
C . 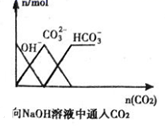 D .
D . 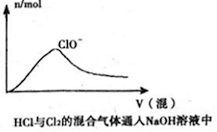
-
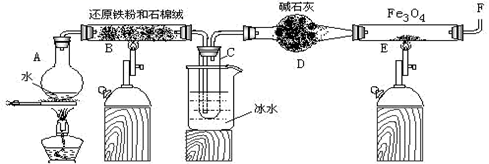
(1) 烧瓶A中常加入碎瓷片,其作用是,小试管C的作用是。
-
(2) 为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
-
(3) 反应3Fe+4H2O(g)
 Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
-
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象。
-
(5) 若E管中反应按以下两步进行:Fe3O4+H2
 3FeO+H2O,FeO+H2
3FeO+H2O,FeO+H2  Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号)
Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号) ①Fe ②Fe和Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉g。(不考虑空气中的成分参与反应)
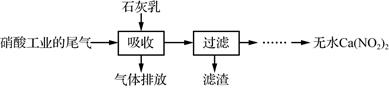
下列说法错误的是( )
-
(1) 实验室欲用浓度为10.0 mol·L-1的浓盐酸配制480 mL 0.250 mol·L-1的稀盐酸,则需要取上述浓盐酸mL。
-
(2) 原混合物中单质铁的质量为g。
 2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1 , 则反应经一段时间后,下列测定数据一定错误的是( )
2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1 , 则反应经一段时间后,下列测定数据一定错误的是( )
 2Z(g) △H<0,若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.2mol/L,0.6mol/L,0.1mol/L,则下列判断不合理的是( )
2Z(g) △H<0,若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.2mol/L,0.6mol/L,0.1mol/L,则下列判断不合理的是( )



