化学实验 知识点题库

实验步骤及现象如下:
Ⅰ. 检查装置气密性后,装入药品并连接仪器。
Ⅱ. 缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ. 待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
Ⅳ. 反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2 , 直至装置中气体变为无色。
回答下列问题:
-
(1) 装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是,解释产生该气体的原因是(用化学方程式表示)。
-
(2) 装置B中湿润的淀粉碘化钾试纸变蓝(生成I2)。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为使试纸变蓝的原因也可能是。
-
(3) 资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2 , 该反应的化学方程式为:。

 中是否混有
中是否混有  B . 用乙装置防止倒吸
C . 用丙装置制取
B . 用乙装置防止倒吸
C . 用丙装置制取  D . 用丁装置制备并收集乙酸乙酯
D . 用丁装置制备并收集乙酸乙酯
| 选项 | 性质 | 用途 |
| A | H2能在O2中燃烧并放出大量的热 | H2用作洁净燃料 |
| B | 硝酸能与苯发生取代反应 | 苯用作溶剂 |
| C | 葡萄糖能与新制Cu(OH)2悬浊液反应 | 葡萄糖可用作甜味剂 |
| D | 乙酸能与NaOH溶液反应 | 乙酸可用作调味剂 |

回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a中的试剂为。
-
(2) c中采用冰水冷却方式的目的是,c中化学反应的离子方程式是。
-
(3) d的作用是,可选用试剂(填标号)。
A Na2SO3 B NaCl C Ca(OH)2 浊液 D H2SO4
-
(4) 反应结束后,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(5) 取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,滴入少量CCl4溶液显紫色,请写出该反应的离子方程式 。
| 选项 | A | B | C | D |
| 实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L−1 K2Cr2O7溶液 |
| 装置或仪器 | | | | |
 B .
B . -
(1) 用如图所示的装置制备K2FeO4。

①A为Cl2发生装置,装置B的作用是。
②装置C中发生反应的离子方程式为。
③当装置C中得到大量紫色固体时立即停止通入Cl2 , 原因是。
-
(2) 某铁矿石的主要成分为Fe2O3和少量Al2O3、SiO2 , 请补充完整由该铁矿石制得高纯度Fe(OH)3的实验方案:(实验中须使用的试剂:稀盐酸、NaOH溶液、AgNO3溶液)。
-
(3) 通过以下方法测定高铁酸钾样品的纯度:称取0.6000g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00mL溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至pH=2,用0.1000mol·L-1硫酸亚铁铵溶液滴定,消耗标准硫酸亚铁铵溶液15.00mL。
测定过程中发生反应:Cr(OH)
 +
+  =Fe(OH)3+
=Fe(OH)3+  +OH-
+OH-2
 +2H+=
+2H+=  +H2O
+H2O +Fe2++H+→Cr3++Fe3++H2O(未配平)
+Fe2++H+→Cr3++Fe3++H2O(未配平)计算K2FeO4样品的纯度(写出计算过程):。
| 选项 | 实验操作和实验现象 | 结论 |
| A | 向 | 氧化性: |
| B | 向盛某盐溶液的试管中滴入浓氢氧化钠溶液并加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含有 |
| C | 将稀盐酸滴入 | 非金属性: |
| D | 将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊 | 碳被氧化成 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溴水中滴加乙醛溶液 | 溶液褪色 | 乙醛能与Br2发生加成反应 |
| B | 无水乙醇和浓硫酸共热到170℃,将气体通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | 反应生成了乙烯 |
| C | 将乙烯通入溴的四氯化碳溶液 | 溶液最终变为无 色透明 | 生成的1,2-二溴乙烷 无色、可溶于四氯化碳 |
| D | 把卤代烃RX与烧碱水溶液混合加热,待冷却后先加入稀硝酸酸化,再加入硝酸银溶液 | 产生白色沉淀 | X为氯原子 |

-
(1) NH4Cl水解(离子方程式)。
-
(2) Na2CO3水解(离子方程式)。
-
(3) Al2(SO4)3和Na2CO3溶液混合(离子方程式)。
-
(4) 在粗制CuSO4.5H2O晶体中常含有杂质Fe2+ , 提纯时为了除去Fe2+ , 常加入酸化的H2O2 溶液作氧化剂,使Fe2+氧化为Fe3+ , 则该反应的离子方程式为
-
(5) ①请写出Na2S溶液中的电荷守恒式
②请写出Na2S溶液中的质子守恒式
③请比较Na2S溶液中的离子浓度大小
-
(6) 下列事实能说明醋酸是弱酸的是(填序号)。
① 醋酸钠溶液中CH3COO-与CH3COOH共存
② 常温下,0.1 mol/L的醋酸钠溶液的pH值约为9
③ 等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④常温下, 0.1mol/L的醋酸的pH值约为4.8
⑤ pH=4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸溶液消耗碱液多

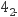 +2HBr
D . 过程①加入试剂的顺序为:Na2CO3 溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
+2HBr
D . 过程①加入试剂的顺序为:Na2CO3 溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
已知: I. 当离子浓度≤1.0×10-5 mol/L时,即认为该离子沉淀完全:
II.T℃时,Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
-
(1) “碱浸”的离子反应方程式是。
-
(2) “沉铝”所得滤液2中的物质 (填化学式) 经过处理可用于沉锂,从而实现联合生产;固体1常用法冶炼出金属。
-
(3) 加H2O2的目的是氧化,检验氧化已经完全的实验是;若将H2O2改为NaClO2也能达成目的,写出加NaClO2反应的离子方程式。
-
(4) “调pH”是使杂质离子形成氢氧化物而沉淀完全,溶液的pH值应不低于。
-
(5) 磷酸亚铁锂电池是一种具有较长使用寿命的二次电池,在充放电过程中表现出了良好的循环稳定性,放电时的总反应为:LixC6+Li1-xFePO4=6C+LiFePO4 , 则正极的电极反应式为。
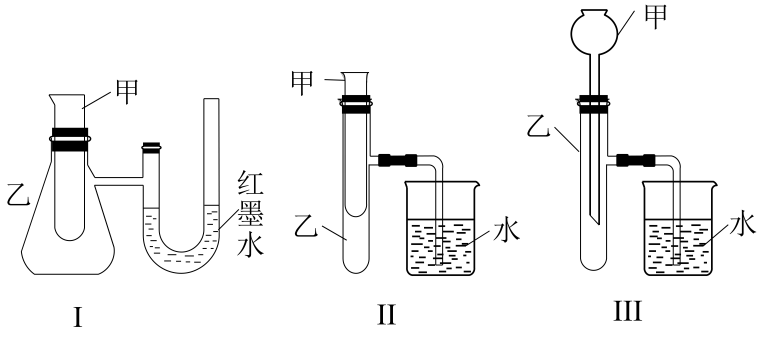
-
(1) 上述3个装置中,不能用于探究“镁与稀盐酸反应是吸热反应还是放热反应”的是(选填“I”、“II”或“III”)。:
-
(2) 某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是,说明该反应属于(选填“吸热”或“放热”)反应。
-
(3) 为探究固体M溶于水的热效应,选择装置II进行实验(在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是。
②若观察到烧杯里产生气泡,则说明M溶于水(选填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”);
③若实验过程中观察到烧杯里的导管内形成一段水柱,则M可能是。
-
(4) 至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是(选填“吸热”或“放热”)反应。
实验操作和现象 | 结论 | |
A. | 在 | 酸性: |
B. | 镁在燃烧匙中点燃,迅速伸入盛满 |
|
C. | 将 |
|
D. | 向蔗糖中加入浓硫酸,蔗糖变成疏松多孔的海绵状 | 浓硫酸具有吸水性和强氧化性 |
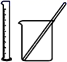
 和
和 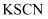 的混合溶液中滴入酸化的
的混合溶液中滴入酸化的  溶液,混合溶液变红
溶液,混合溶液变红

 溶液中,溶液中出现凝胶
溶液中,溶液中出现凝胶

 溶液中通入
溶液中通入 气体,有沉淀生成
气体,有沉淀生成
 的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生
的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生 溶液滴入酸性
溶液滴入酸性 溶液中,紫红色褪去
溶液中,紫红色褪去 有还原性
有还原性


