常见气体制备原理及装置选择 知识点题库
①将蒸馏烧瓶固定在铁架台上
②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中
④检查装置的气密性(利用对固定装置微热的方法检查气密性)
⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g)+Cl2(g) ![]() SO2Cl2(l) ΔH=-97kJ/mol;
SO2Cl2(l) ΔH=-97kJ/mol;
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
-
(1) 硫酰氯在潮湿空气中“发烟”的原因是(用化学方程式表示)。
-
(2) 检验装置G气密性的方法是。
-
(3) 装置A中发生反应的离子方程式为。
-
(4) H的作用是,其中水流的方向是→(填a或b)。
-
(5) 装置C、F中的试剂相同,盛放的试剂为。
-
(6) 该装置存在的一处缺陷是。
-
(7) 若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论):
。仪器自选;供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。

-
(1) 装置A产生SO2 , 按气流方向连接各仪器接口,顺序为 a→→→→→f.
-
(2) 验证产生的气体是 SO2的方法及实验现象是.
-
(3) 若在1L 0.3mol/L的 NaOH溶液中,通入4.48L SO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3﹣)+2c(SO32﹣)+c(OH﹣),请再写出两个等量关系:.

-
(1) 实验室里用乙醇和浓硫酸共热制取乙烯,(填“能”或“不能”)能否选用上述装置来完成实验;如果不能,应该选用哪种装置并在此装置上作什么改进即可完成该实验?.
-
(2) 实验室制取HCl气体可选用A,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,选用装置也可以制取HCl气体,下列叙述不属于制取HCl气体理由的是
A、浓硫酸具有脱水性; B、浓硫酸具有吸水性
C、盐酸具有挥发性; D、气态物质的溶解性随温度的升高而降低
-
(3) 现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2 . 若选装置B,则需选用的试剂为;若选装置C,则需选用的试剂为.
-
(4) 若把装置图1中的A与图2相连,在实验室可用来制取下列气体中的(填序号)
①NO2②Cl2 ③HCl ④NH3
写出实验室制取该气体的化学方程式:图2小烧杯所盛液体的作用为.

-
(1) 选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥、纯净的CO2 , 产生的气流应依次通过盛有、的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是。不能用稀硫酸代替稀盐酸,其原因是。

-
(2) 金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤
现象
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却
产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生
在集气瓶中加入适量蒸馏水,振荡、过滤
滤纸上留下黑色固体,滤液为无色溶液
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。据此推断,白色物质的主要成分是(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是。
③本实验中金属钠与二氧化碳反应的化学方程式为。


| 选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
| A | 氯酸钾、MnO2 | 浓硫酸 | O2 |
| B | 石灰石、稀盐酸 | NaHCO3溶液 | CO2 |
| C | Zn、稀硫酸 | 浓硫酸 | H2 |
| D | MnO2、浓盐酸 | 浓硫酸 | Cl2 |
(制备NaClO溶液)

实验装置如图甲所示部分夹持装置已省略
已知:3NaClO  2NaCl+NaClO3
2NaCl+NaClO3
-
(1) 请写出肼的电子式。
-
(2) 配制30%NaOH溶液时,所需玻璃仪器除量筒外还有。
-
(3) 装置I中发生的化学反应方程式是 ;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是。
-
(4) (制取水合肼)
实验装置如图乙所示。
仪器B的名称为;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式。
-
(5) 充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为。

-
(1) 上图所示的氧化物指的是含种元素的化合物。
-
(2) 以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
物质类别
酸
碱
盐
氧化物
氢化物
化学式
①HCl
②
③
④Ba(OH)2
⑤Na2CO3
⑥
⑦CO2
⑧Na2O
⑨NH3
⑩H2O2
-
(3) 写出⑦转化为⑤的化学方程式。
-
(4) 实验室制备⑦常用反应,检验该气体的方法是。
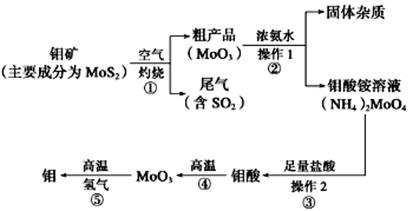
-
(1) 写出在高温下发生反应①的化学方程
-
(2) 生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:
-
(3) 如果在实验室模拟操作 1 和操作 2,则需要使用的主要玻璃仪器有
-
(4) 某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是
② 在烧瓶 A 中加入少量硫酸铜的目的是
③ 两次使用 D 装置,其中所盛的药品依次是、
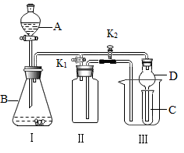
-
(1) 利用I、Ⅱ装置可制取收集气体(K2关闭,K1打开)。
①下列各组物质中能直接利用这套装置进行实验的是(填正确选项的标号)。
A.锌和稀硫酸B.双氧水和二氧化锰
C.浓氨水和氧化钙D.浓盐酸和二氧化锰
②在不改变I、II装置及位置的前提下,若要制取收集NO气体,可采取的改进方法是装置II内充满水;若要制取收集NO2气体,可采取的改进方法是:。
-
(2) 利用I、III装置可验证物质的性质(K2打开,K1关闭)。
①若要证明氧化性:KMnO4>Cl2>Br2 , 则A中加浓盐酸,B中加KMnO4 , C中发生的离子反应方程式。
②若要证明乙炔为不饱和烃,则I中发生的化学反应方程式为:。C中的现象为(假设乙炔纯净)。
-
(3) 装置Ⅲ中使用球形干燥管D的作用为。
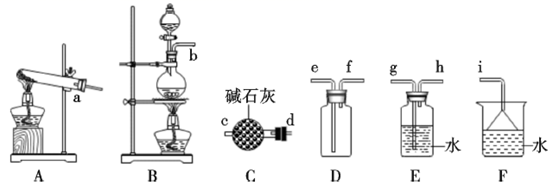
-
(1) 氨气的制备
①氨气的发生装置中反应的化学方程式为。装置C的仪器名称。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→(按气流方向,用小写字母表示)。
-
(2) 氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤
实验现象
解释原因
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中
①Y管中
②反应的化学方程式
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
③
④
| 选项 | 实验目的 | 实验方案 |
| A | 制取少量氨气 | 将浓氨水滴入碱石灰中 |
| B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量 |
| C | 检验亚硫酸钠溶液是否变质 | 取样,加入足量用硝酸酸化的硝酸钡溶液 |
| D | 制备少量氯化氢气体 | 向浓盐酸中滴加浓硫酸 |
|
熔点/℃ |
沸点/℃ |
其他 |
|
|
PCl3 |
-112 |
75.5 |
遇水生成H3PO3和HCl |
|
POCl3 |
2 |
105.3 |
遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如图(某些夹持装置、加热装置已略去):

-
(1) 装置A用来制氧气,在常温下通常用黑色固体和液态物质反应。写出A中的化学反应方程式。
-
(2) B装置的作用除干燥O2外,还有、。
-
(3) 装置E用来制取Cl2 , 反应的离子方程式为。
-
(4) 反应时,需严格控制三个条件:
①先制取Cl2 , 缓慢地通入C中,直至C中的白磷消失后,再通入O2。
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是。
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为 (写化学式)。
-
(5) 为使实验顺利进行,球形冷凝管a上口还需补充的装置为。
气体 | 制备试剂 | 除杂试剂 | 所选装置 | |
A | SO2 | Cu+浓H2SO4 | 饱和NaHSO3溶液 | b、c |
B | Cl2 | MnO2+浓HCl | 饱和NaCl溶液 | b、c |
C | C2H4 | C2H5OH+浓H2SO4 | KMnO4溶液 | b、c |
D | C2H2 | 电石+饱和NaCl溶液 | CuSO4溶液 | a、c |
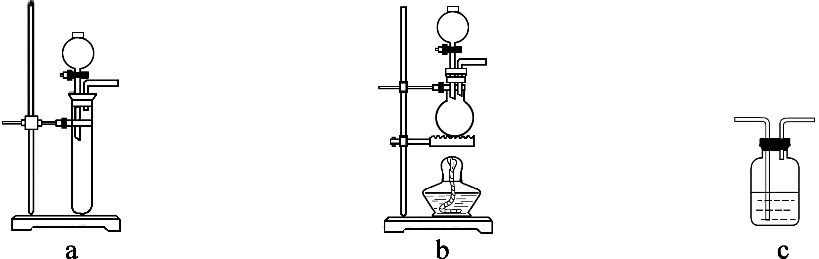
 B . 除去Na2CO3中的NaHCO3
B . 除去Na2CO3中的NaHCO3 C . 制取并收集一定Cl2
C . 制取并收集一定Cl2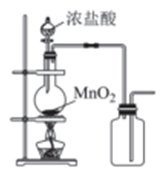 D . 乙醇加热条件下能还原氧化铜
D . 乙醇加热条件下能还原氧化铜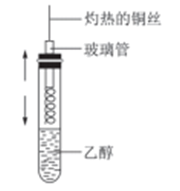


-
(1) 检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到,则气密性良好。
-
(2) 装置A中反应的化学方程式为。
-
(3) 实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有(填“还原性”、“氧化性”或“漂白性”)。
-
(4) 取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为(写化学式)
②原试管D中反应的离子方程式为。
-
(5) 用如图所示装置验证H2SO3酸性比H2CO3强。
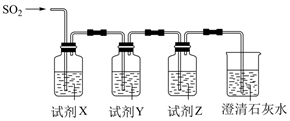
请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和Na2CO3溶液
X为,Y为,Z为。




