常见气体制备原理及装置选择 知识点题库
如图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是( )
实验室用环戊醇(沸点160.8℃,密度0.96g/mL)与溴化氢反应制备溴代环戊烷(沸点138℃,密度1.37g/mL),其反应原理如下: OH+NaBr+H2SO4
OH+NaBr+H2SO4
 Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
 B .
B .  C .
C .  D .
D . 
-
(1) 提出假设 ①该反应的气体产物是CO2 .
②该反应的气体产物是CO.
③该反应的气体产物是
-
(2)
设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.

查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气.
请写出该反应的离子方程式:
-
(3) 实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2 , 其作用分别为
-
(4) 数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
-
(5) 实验优化 学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:

-
(1) 实验室利用A 发生装置制备的常见气体有.
-
(2) 检验装置B的气密性方法是.
-
(3) 收集一瓶纯净氯气,选择上图装置,按气流方向,用小写字母表示连接顺序(装置不重复使用).实验室检验氯气的方法是.
-
(4) 某实验小组按顺序连接adcfeg制取并收集氨气,导致实验失败,原因是.
 配制一定浓度硫酸溶液
B .
配制一定浓度硫酸溶液
B .  制备少量氨气
C .
制备少量氨气
C .  制备并收集少量NO2气体
D .
制备并收集少量NO2气体
D .  制备少量氧气
制备少量氧气

-
(1) 仪器a的名称是;搭建B装置时,酒精灯应在固体仪器a之(选填“前”或“后”)放置.
-
(2) 实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是.
-
(3) 在实验室制取二氧化碳的研究中,进行了如下实验:
实验编号
药品
甲
乙
丙
丁
大理石
mg,块状
mg,块状
mg,粉末状
mg,粉末状
盐酸(过量)
wg,稀盐酸
wg,浓盐酸
wg,稀盐酸
wg,浓盐酸
①上述实验中反应的化学方程式是.
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与对照(选填实验编号).
③除盐酸的浓度外,上述实验研究的另一个影响反应因素是.
④研究发现酸的浓度越大,产生气体的速度越快.与甲比较,对丁分析正确的是.(选填编号)
a.反应更为剧烈 b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高.

-
(1) 最轻的气体是;
-
(2) 因与人体血红蛋白结合而使人中毒的物质;
-
(3) 白酒、啤酒、红酒等酒精类饮料中的主要溶质;
-
(4) 实验室制备氧气的反应原理(用化学方程式表示)。
-
(5) 农村的情洁能源沼气燃烧的化学方程式;
-
(6) 生成物能使澄清石灰水变浑浊的化合反应。

-
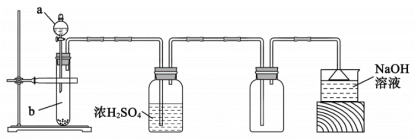
(1) 装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸和98%浓硫酸,其原因是。
-
(2) 装置B中发生反应的离子方程式为。
-
(3) 装置C的作用是。
-
(4) 从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。检验己洗涤完全的方法是。
-
(5) 请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O) 的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入溶液,加入适最纯净的调节3.2<pH<4.2,静置,过滤,将滤液水浴加热蒸发浓缩至表面出现晶膜,冷却结晶,过滤,用95% 酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2 (5.8, 8.8); Cu(OH)2 (4.2, 6.7); Fe(OH)3 (1.1,3.2)]
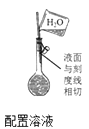 B .
B .  C .
C . 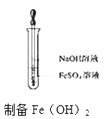 D .
D . 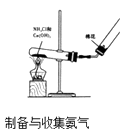
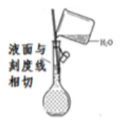 定容
B .
定容
B . 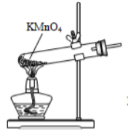 制备氧气
C .
制备氧气
C . 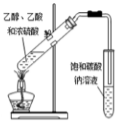 制备乙酸乙酯
D .
制备乙酸乙酯
D .  实验室制硝基苯
实验室制硝基苯
| 选项 | 制备的气体 | 化学试剂与反应条件 |
| A | 氧气 | 二氧化锰与双氧水,不需要加热 |
| B | 二氧化硫 | 硫与氧气,燃烧 |
| C | 氨气 | 硝酸铵溶液,受热 |
| D | 乙炔 | 电石与饱和食盐水,加热 |
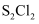 )是橡胶工业的硫化剂,在冶金工业也可用作金、银等贵稀金属的萃取剂。实验室可用以下两种原理制备
)是橡胶工业的硫化剂,在冶金工业也可用作金、银等贵稀金属的萃取剂。实验室可用以下两种原理制备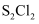 :
:① ②
②
已知: ;
;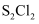 在300℃以上完全分解产生两种单质。
在300℃以上完全分解产生两种单质。
下表是几种物质的熔沸点:
物质 | S | CS2 |
|
|
|
熔点/℃ | 112.8 | -109 | -23 | -77 | -121 |
沸点/℃ | 444.6 | 47 | 77 | 137 | 59.6 |
某实验小组利用以下装置制备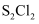 , 回答下列问题:
, 回答下列问题:

-
(1) 实验小组欲采用原理②制备
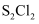 , 则实验装置应选择(填A或B)。
, 则实验装置应选择(填A或B)。
-
(2) 仪器c的名称为,仪器b的作用是。
-
(3) 如果在加热a时温度过高,对实验结果的影响是,在b中可能出现的现象是。
-
(4) 上述方案得到的
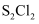 粗品中可能混有的杂质是。
粗品中可能混有的杂质是。
-
(5) 实验中加入固体硫质量为6.40 g硫,反应后得到产物浅黄色
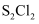 液体4.60mL,则
液体4.60mL,则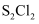 的产率为。(
的产率为。(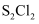 密度1.68g/mL,保留三位有效数字)
密度1.68g/mL,保留三位有效数字)
选项 | 制备气体 | 装置a中药品 | 装置b中药品 |
A |
| 浓盐酸 |
|
B |
| 稀硫酸 | 大理石 |
C |
| 稀硫酸 | 锌粒 |
D |
| 浓硫酸 |
|

 固体和浓硫酸制
固体和浓硫酸制 C . 用
C . 用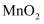 和浓盐酸制
和浓盐酸制 D . 用
D . 用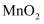 和
和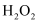 制
制

| 选项 | 气体 | 反应试剂 | 制备装置 | 收集方法 |
| A | NH3 | Ca(OH)2、NH4Cl | a | e |
| B | Cl2 | MnO2、浓盐酸 | c | d |
| C | NO | Cu、浓硝酸 | c | d |
| D | SO2 | Na2SO3、70%硫酸 | b | f |

完成下列填空:
-
(1) 电解饱和食盐水的化学方程式为。检验氢氧化钠溶液中是否含有NaCl的实验方法是。
-
(2) 利用图装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有;若其它操作不变,将A与C连接,②中观察到的现象是。

-
(3) 探究发现NaClO溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。试用平衡移动原理和物质变化的相关知识加以解释。

-
(4) 氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中NaOH的含量。
其实验步骤为:称取工业烧碱2.088 g,配成500 mL溶液,取出25.00 mL,先加入25.00 mL 0.05 mol•L-1 BaCl2溶液(过量),然后滴入酚酞指示剂,再用0.1200 mol•L-1 的盐酸滴定至终点,平均消耗盐酸18.56 mL。
滴加BaCl2溶液时,反应的离子方程式为。计算该样品中NaOH的质量分数为。(用小数表示,保留至小数点后第3位),某次检测发现,实验值明显高于理论值,原因可能是。(选填编号)
a.工业烧碱已发生潮解 b.滴定管水洗后未用标准盐酸润洗
c.配制的待测液敞口放置时间过长 d.滴定时往锥形瓶中加水
-
(5) 该方案无需过滤掉碳酸钡就直接用盐酸滴定,但不会影响实验精准度,原因是。

 移向负极实现化学能转化为电能
C . 图丙装置,从下层放出
移向负极实现化学能转化为电能
C . 图丙装置,从下层放出 实现与水的分离
D . 图丁装置,制备
实现与水的分离
D . 图丁装置,制备








