比较弱酸的相对强弱的实验 知识点题库

-
(1) HA为酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的
c(H+)醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为碱(填“强”或“弱”).
-
(2) 常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是 .A . c(H+) B . c(H+)/c(CH3COOH) C . c(H+)•c(OH﹣) D . c(OH﹣)/(H+)
-
(3) 常温下,用0.10mol•L﹣1 NaOH溶液分别滴定20mL 0.10mol•L﹣1 HCl溶液和20mL 0.10 mol•L﹣1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示).
-
(4) 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为

①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt 易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3  CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
 溶液中滴加
溶液中滴加  的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( ) 
 B . B点时加入HA和氨水恰好完全反应
C . A点所示溶液中:
B . B点时加入HA和氨水恰好完全反应
C . A点所示溶液中:  D . C点所示溶液中:
D . C点所示溶液中: 
-
(1) (探究一)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置A中盛固体的玻璃仪器名称是,装置A中反应的离子化学方程式为。
-
(2) 装置连接顺序为A,其中装置C的作用是,通过现象,即可证明亚硫酸的酸性强于次氯酸。
-
(3) (探究二)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100mL容量瓶中,再定容至凹液面与刻度线相平。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
-
(4) Na2S2O3常用于脱氯剂,在溶液中易被氯气氧化为SO42- , 该反应的离子方程式为。
| 编号 | 实验目的 | 实验过程 |
| A | 探究化学能可转化为热能 | 在试管中加入3 mL 6mol×L-1的盐酸,再插入用砂纸打磨过的铝条,并用温度计测量温度的变化 |
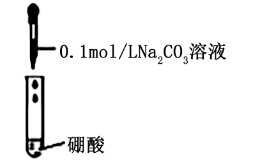
| B | 比较弱电解质的相对强弱 | 向两支分别盛有0.1 mol×L-1醋酸和硼酸溶液的试管中滴加等浓度的碳酸钠溶液,观察现象 |
| C | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL 5% H2O2溶液,观察现象 |
| D | 探究催化剂对反应速率的影响 | 向2支盛有2mL5%H2O2溶液的试管中分别同时滴加1mL 0.1 mol×L-1 FeCl2和CuCl2溶液,摇匀观察现象 |
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| K1 | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断下列说法正确的是( )
-
(1) 小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

仪器A的名称是,应盛放下列药品中的。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
-
(2) 仪器B的名称是,应盛放下列药品中的。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
-
(3) 仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为。
-
(4) 用电子式表示下列化合物的形成过程:
CaF2:
H2S:
-
(5) 有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是,
②既存在离子键又存在极性键的是。
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
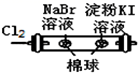
| D | | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A | B | C | D |
| | | | |
| 观察甲烷与氯气在光照条件下的反应 | 除去甲烷中少量的乙烯 | 证明元素的非金属性:C>Si | 蒸馏石油获取汽油 |


回答下列问题:
-
(1) 写出W的离子结构示意图。
-
(2) Z、Q两种元素最简单离子半径的大小顺序为(用离子符号表示)。
-
(3) X元素的最低价氢化物的电子式是,写出实验室制取该氢化物的化学方程式。
-
(4) Q元素单质与金属钠性质相似,则Q的过氧化物中含有的化学键有(填化学键名称),写出该物质与水反应的离子方程式。
-
(5) 比较Z、W原子的得电子能力强弱。
方法一:比较Z、W两种元素最高价氧化物对应水化物的酸性强弱(用化学式回答);
方法二:比较单质的氧化性强弱,设计实验证明(请简述试剂、操作、现象、结论):。
-
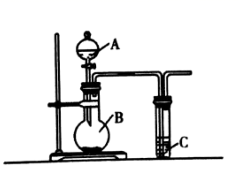
(1) 仪器A的名称为。
-
(2) 若要证明非金属性:Cl>S,则可在A中加浓盐酸,B中加KMnO4(已知:KMnO4与浓盐酸常温下反应可生成氯气),C中加入Na2S溶液,观察到C中产生淡黄色浑浊的现象,即可证明,C中发生反应的离子方程式为,若从环境保护的角度考虑,此装置还缺少尾气处理装置,可用溶液吸收尾气。
-
(3) 现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4>H2CO3>H2SiO3 , 回答下列问题:
①A中试剂为,B中试剂为。
②要得出酸性H2SO4>H2CO3>H2SiO3的结论,则C中应观察到的现象为。
-
(4) 利用如图装置证明SO2气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末,C中加入品红溶液。打开分液漏斗活塞,一段时间后C中观察到的现象是,待反应完全后,将试管C加热一段时间发生的现象是,即可证明SO2气体具有漂白性。
| 编号 | 实验目的 | 实验方案 |
| ① | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和 |
| ② | 证明淀粉未水解 | 向淀粉溶液中加稀硫酸,加热,加新制 |
| ③ | 检验丙烯醛 | 将丙烯醛滴入溴的四氯化碳中,观察溴的四氯化碳是否褪色 |
| ④ | 证明酸性:醋酸>碳酸>苯酚 | 向纯碱中滴加醋酸,将产生的气体通入苯酚钠浓溶液 |
| 序号 | 试剂及操作 | 部分现象 | 结论 |
| A | | 滴入稀盐酸后铜片继续溶解,产生无色气体,在试管口处变为淡棕色 | 盐酸具有氧化性 |
| B | | 有气体生成 | 酸性: 硼酸强于碳酸 |
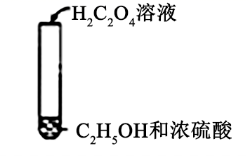
| C | | 加热后产生有香味物质 | H2C2O4可发生酯化反应 |
| D | | 试管内红色褪去 | SO2具有漂白性 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中,滴加氯水后,再滴加KSCN溶液,结果溶液变为红色 | 该溶液中一定含有Fe2+ |
| B | 向硫酸催化下的淀粉溶液中,加入新制Cu(OH)2悬浊液,并加热,结果未生成砖红色沉淀 | 该淀粉溶液一定未水解 |
| C | 向AgNO3溶液中加入NaCl溶液,生成白色沉淀,再滴加Na2S溶液,又生成黑色沉淀 | Ksp(AgCl)>Ksp(Ag2S) |
| D | 用醋酸浸泡有水垢的水壶,能除去水垢 | 酸性:CH3COOH>H2CO3 |
 是弱电解质的是( )
是弱电解质的是( )
 溶液的
溶液的 B . 用某
B . 用某 溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与
溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与 溶液分别和足量锌反应,
溶液分别和足量锌反应, 放出的氢气较多
D . 将
放出的氢气较多
D . 将 的
的 溶液稀释100倍,稀释后溶液的
溶液稀释100倍,稀释后溶液的
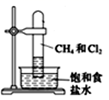
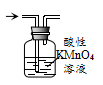

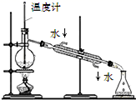
 的乙醇溶液,加热,将反应产生的气体通入酸性高锰酸钾溶液中
的乙醇溶液,加热,将反应产生的气体通入酸性高锰酸钾溶液中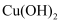 ,加热未见红色沉淀
,加热未见红色沉淀 中的碳碳双键
中的碳碳双键