比较弱酸的相对强弱的实验 知识点题库
-
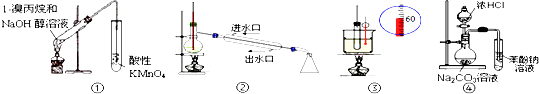
(1) 下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 (填标号).A . 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B . 氢硫酸的导电能力低于相同浓度的亚硫酸 C . 0.10mol•L﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D . 氢硫酸的还原性强于亚硫酸
-
(2)
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、,制得等量H2所需能量较少的是.
-
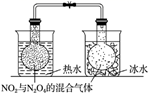
(3) H2S与CO2在高温下发反应:生H2S(g)+CO2(g)⇌COS(g)+H2O(g).在610k时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
①H2S的平衡转化率a1=%,反应平衡常数K=.
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .
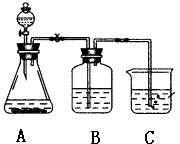
-
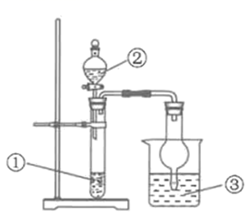
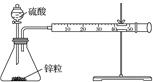
(1) 锥形瓶内装某可溶性盐,写出A中反应的离子方程式:;
-
(2) 写出C中反应的化学方程式:;
-
(3) B中的试剂为.
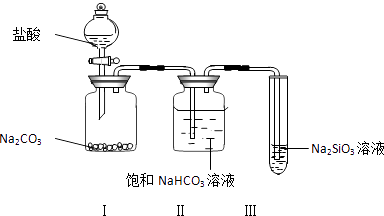
回答下列问题.
-
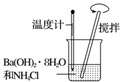
(1) 装置Ⅰ中的现象是,装置Ⅱ的作用是,其中可能发生反应的离子方程式是.
-
(2) 装置Ⅲ中的现象是,反应的化学方程式是.
-
(3) 该实验的实验结论是.
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一片鲜花花瓣放入盛有干燥氯气的集气瓶中 | 鲜花花瓣未变色 | 干燥的氯气没有漂白性 |
| B | 向某溶液中滴入几滴K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 | 该溶液中含有Fe3+ |
| C | 测定等浓度的Na2C2O4的溶液和Na2CO3溶液的pH | Na2CO3溶液的pH较大 | 酸性:H2C2O4>H2CO3 |
| D | 常温下,向含等浓度Mg2+和Cu2+的溶液中逐滴加入NaOH溶液 | 先生成蓝色沉淀 | 常温下,Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将高氯酸与苏打溶液混合产生气体经饱和碳酸氢钠溶液除杂后,通入硅酸钠溶液中 | 硅酸钠溶液中出现白色沉淀 | 非金属性: Cl>C>Si |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ , 无K+ |
| C | 相同温度下,向2mL0.2mol·L-1 NaOH溶液中滴加2滴0.1mol·L-1 MgSO4溶液,再滴入2滴0.1mol·L-1 CuSO4溶液 | 先产生白色沉淀,后生成蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
| D | 向KI溶液中加入淀粉,然后再加1.0molL-1H2SO4溶液 | 开始无明显现象,加入硫酸后溶液变蓝 | H2SO4将I-氧化为I2 |
|
H |
① |
||||||
|
② |
③ |
O |
④ |
||||
|
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||
-
(1) 元素①~⑨形成的单质中,化学性质最稳定的是(填化学式)。④在元素周期表中的位置是,⑥的简单离子的结构示意图为
-
(2) ③、⑨和H元素可形成一种常见的盐,其中存在的化学键类型为,⑤、⑧按原子个数比2:1形成的化合物的电子式为
-
(3) 写出一个可证明②和⑦非金属性强弱的离子方程式:
-
(4) 在酸性溶液中,②的简单氢化物与O2组成燃料电池,其负极的电极反应式为
| A | B | C | D |
| | | | |
| 探究温度对化学平衡的影响 | 探究醋酸、碳酸、苯酚的酸性强弱 | 定量测量化学反应速率 | 探究反应中的热量变化 |
| 编号 | Ⅰ | Ⅱ |
| 实验 | | |
| 现象 | a中产生凝胶状沉淀 | b中凝胶状沉淀溶解,c中无明显变化 |
下列结论正确的是( )
 +CO2+H2O=
+CO2+H2O=  +H2SiO3↓
+H2SiO3↓
| 选项 | ① | ② | ③ | 实验结论 |
| A | Na2CO3 | 盐酸 | Na2SiO3 | 酸性:H2CO3>H2SiO3 |
| B | Na2SO3 | 浓硫酸 | 溴水 | SO2具有还原性 |
| C | KClO3 | 浓盐酸 | 淀粉-KI溶液 | 氧化性:KClO3>Cl2>I2 |
| D | CaO | 浓氨水 | 滴加酚酞的水溶液 | NH3的水溶液显碱性 |
| 选项 | 实验目的 | 实验方案 |
| A | 比较HCl和HClO的酸性强弱 | 分别测定等浓度的HCl和HClO溶液的导电能力大小 |
| B | 验证Na2S2O3是否氧化变质 | 在Na2S2O3溶液中滴加稀盐酸,然后滴加BaCl2溶液观察是否产生白色沉淀 |
| C | 证明Fe2+有还原性 | 向较浓的FeCl2溶液中滴人少量酸性KMnO4溶液,观察KMnO4溶液紫色是否褪去 |
| D | 比较K(AgBr) <K(AgCl) | 向NaCl与NaBr混合溶液中滴加AgNO3溶液,观察是否出现淡黄色沉淀 |
 B . pH相等的盐酸和醋酸溶液,则
B . pH相等的盐酸和醋酸溶液,则 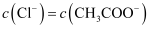 C .
C . 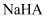 溶液呈酸性,则
溶液呈酸性,则  一定是强酸
D . 若溶液中
一定是强酸
D . 若溶液中 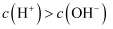 ,则溶液一定呈酸性
,则溶液一定呈酸性
| 目的 | 操作 | |
| A | 证明FeCl3和KSCN溶液反应可逆 | 将同浓度的KSCN和FeCl3溶液等体积混合后再滴加少量KSCN液观察溶液颜色变化 |
| B | 证明酸性:碳酸>苯酚 | 将硝酸溶液与NaHCO3混合产生的气体直接通入苯酚钠溶液 |
| C | 证明Ksp(AgCl)>Ksp(AgBr) | 向含有相同Cl-和Br-浓度的溶液中滴加少量AgNO3溶液 |
| D | 证明H2O2具有强氧化性 | 向 |
 的水溶液的酸性逐渐增强
B .
的水溶液的酸性逐渐增强
B .  、
、  、
、  、
、  的还原性逐渐减弱
C . 单质
的还原性逐渐减弱
C . 单质  、S、P的氧化性逐渐减弱
D .
、S、P的氧化性逐渐减弱
D . 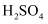 、
、 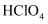 、
、  的酸性逐渐减弱
的酸性逐渐减弱
| 选项 |
实验目的 |
实验操作 |
| A |
探究化学反应是否可逆 |
向
|
| B |
探究浓度对盐类水解平衡的影响 |
向滴有酚酞的碳酸钠溶液中滴加氯化钡溶液,观察现象 |
| C |
比较AgI和AgCl溶度积大小 |
向
|
| D |
比较HClO和
|
用pH试纸测定NaClO溶液和 |
选项 | 实验操作 | 现象 | 解释或结论 |
A | 加热NaI固体和浓磷酸的混合物 | 有气体产生 | 生成了HI气体 |
B | 取等物质的量的Al和Fe,分别与足量的稀盐酸反应 | Al产生的氢气多 | 金属性:Al>Fe |
C | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 酸性:苯酚>碳酸 |
D | 分别在20℃、30℃下,取0.1mol·L-1KI溶液,向其中先加入0.1mol·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I-=2I2+2H2O | 30℃下出现蓝色的时间短 | 探究反应速率与温度的关系 |
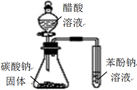


 H2O2溶液中滴加
H2O2溶液中滴加 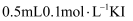 溶液中滴加1~2滴
溶液中滴加1~2滴
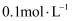 的
的
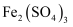 溶液,充分反应后,滴入1~2滴
溶液,充分反应后,滴入1~2滴
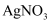 溶液,生成黄色沉淀
溶液,生成黄色沉淀 酸性强弱
酸性强弱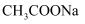 溶液的pH
溶液的pH


