探究铝热反应 知识点题库

-
(1) 氧化铁与铝反应的化学方程式是,
-
(2) 镁带的作用是;氯酸钾的作用是.
-
(3) 同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2054
1535
1462
沸点/℃
2467
2980
2750
﹣
同学们分析数据后推测该熔融物是一种合金,其中的金属是,溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
-
(1) Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?(填“合理”或“不合理”).
-
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是,反应的离子方程式为.
-
(3) 实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号).A . 浓硫酸 B . 稀硫酸 C . 稀硝酸 D . 氢氧化钠溶液
-
(4)
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

图中OC段没有沉淀生成,此阶段发生反应的离子方程式为.
-
(5) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式;
-
(6) A点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
-
(1) I.某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释(填“合理”或“不合理)
-
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是,反应的离子方程式为.
-
(3) II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示.

请回答下列问题:
图中OC段没有沉淀生成,此阶段发生反应的离子方程式为.在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为.
-
(4) B与A的差值为 mol,B点对应的沉淀的物质的量为mol,C点对应的氢氧化钠溶液的体积为ml.

-
(1) 取磁性氧化铁按图所示装置进行铝热反应,引发铝热反应的实验操作是。取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变为血红色。出现这种现象,一方面可能因为“铁块”中混有没反应的磁性氧化铁,另一方面可能因为。
-
(2) 请写出此铝热反应的化学方程式:,1 mol Al参与反应,转移的电子数为。
-
(3) 设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是,反应的离子方程式为。
-
(4) 除了磁性氧化铁可做铝热反应实验,下列试剂也可以发生铝热反应的是________(填字母,双选)。A . CuO B . Na2O2 C . MnO2 D . MgO
-
(1) 迄今为止人类冶炼最多的金属是。
-
(2) 纯净的铁的颜色是;纯净的铝的颜色是。
-
(3) 铁丝在氧气中燃烧的现象,化学反应方程式。
-
(4) 铝粉与某些金属氧化物组成的混合物在高温下可以发生铝热反应。信息中“某些”指。(选填“比铝活泼的”、“比铝不活泼的”或“任意”)写出铝粉与MnO2发生的铝热反应方程式。
-
(5) 将5.5g铝铁混合物溶于足量的稀硫酸中,在标准状况下收集到氢气4.48L,则混合物中铝的质量分数为。

回答下列问题:
-
(1) 固体A的成分是(填化学式)。
-
(2) 由溶液B生成溶液C的离子方程式为;检验溶液C中金属阳离子的试剂是(填名称)。
-
(3) 检验固体E是否洗涤干净的操作为;灼烧时,用于盛放固体E的仪器为(填名称)。
-
(4) 铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式。
| 选项 | 陈述I | 陈述II |
| A | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
-
(1) 写出氯原子的原子结构示意图,NH4Cl的电子式;
-
(2) 用电子式表示H2O的形成过程;
-
(3) 已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量(填“高”、“低”),故白磷比红磷稳定性(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,放出热量多。
-
(4) 在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
-
(5) 电解法冶炼金属铝的化学方程式为。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为,引发铝热反应的实验操作是。
-
(1) Ⅰ.引发铝热反应的实验操作是
-
(2) 做铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是
-
(3) 反应的化学方程式为
-
(4) Ⅱ.已知:Al、Fe的熔、沸点数据如下:
物质
Al
Fe
熔点(℃)
660
1 535
沸点(℃)
2 467
2 750
某同学猜测,铝热反应所得到的熔落物是铁铝合金。理由:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?(填“合理”或“不合理”)。设计一个简单的实验方案,证明上述所得的熔落物中含有金属铝:
| A | B | C | D | |
| Y | CO2 | SiO2 | Na2O2 | Fe2O3 |
| W | MgO | CO | NaOH | Al2O3 |
-
(1) 利用铝与氧化铁可以焊接钢轨,发生反应的化学方程式为,该反应属于(填“放热”或“吸热”)反应。
-
(2) 在100mL稀盐酸中加入足量镁条,反应生成H2的体积(标准状况)与反应时间的关系如1图所示:

①2~6min内用稀盐酸表示的平均反应速率为(精确到0.0001)mol•L1•min-1。
②从图可以看出,4min后反应速率逐渐减慢,原因是。
-
(3) 以Al、Mg为电极,可以组装如图2所示原电池装置:

①若电解质溶液为稀硫酸,则Mg上发生的电极反应式为,当有2.4gMg溶解时,Al电极上生成(标准状况)L氢气。
②若电解质溶液为NaOH溶液,则外电路中的电子(填“流出”或“流入”)Al电极。
| 选项 | 事实 | 解释 |
| A | 单晶硅用于制造光导纤维 | 单晶硅可使光发生全反射 |
| B | 泡沫灭火器是利用 | |
| C | 利用铝热剂( | 铝置换出铁吸收能量使铁凝固 |
| D | 用乙醇洗去织物上的油污 | 乙醇能与油污发生取代反应 |
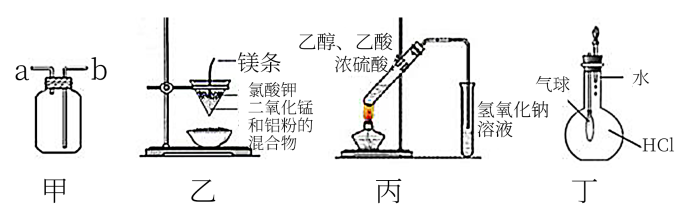
 , 也可以用来收集
, 也可以用来收集 B . 装置乙∶根据铝热反应原理可制得金属锰
C . 装置丙∶实验室制取乙酸乙酯
D . 装置丁∶挤压胶头滴管水滴下后,气球会鼓起来
B . 装置乙∶根据铝热反应原理可制得金属锰
C . 装置丙∶实验室制取乙酸乙酯
D . 装置丁∶挤压胶头滴管水滴下后,气球会鼓起来
 溶液与饱和
溶液与饱和  溶液混合产生气体
溶液混合产生气体 与
与  的水解相互促进,生成阻燃性气体
的水解相互促进,生成阻燃性气体  ,隔绝空气
,隔绝空气 和
和  )焊接钢轨
)焊接钢轨


