探究铝热反应 知识点题库
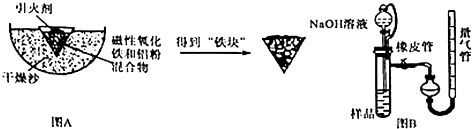
-
(1) 实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是.
-
(2) 该铝热反应的化学方程式为.
-
(3) 取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气体体积以测量样品中残留铝的百分含量.试回答下列问题:
①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为.
②量气管在读数时必须进行的步骤是.
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为.
④装置中分液漏斗上端和烧瓶用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用.如果装置没有橡胶管,测出铝的百分含量将会(填“偏大”或“偏小”).
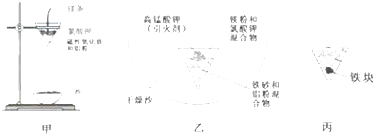
-
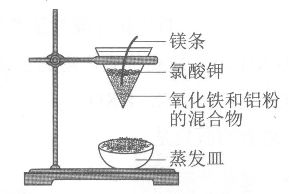
(1) 取磁性氧化铁按图甲装置进行铝热反应,现象很壮观.取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种结果的原因,除了可能混有没反应的磁性氧化铁外,还有一个原因是.
-
(2) 为了克服图甲的缺陷,改用图乙装置进行铝热反应,主要步骤如下:
①在一个广口容器中放进一定量的干燥细沙;
②将一定量的铁砂和铝粉混合物装在纸漏斗中并埋入细沙里;
③将一定量的镁粉和氯酸钾混合物放在铝热剂上;
④再放上引火剂;引火反应,冷却;⑤取出反应后的铁块(如图丙)
请写出铝热反应的化学方程式:取少许反应生成的铁块溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.实验中干燥细沙的主要作用是.
-
(3) 测定图乙反应所得的铁块纯度,流程如图所示.几种氢氧化物开始沉淀和沉淀完全时的pH参考表格
Fe2+
Fe3+
Al3+
Mg2+
开始沉淀时的pH
7.5
2.8
4.2
9.6
沉淀完全时的pH
9.0
4.0
5
11
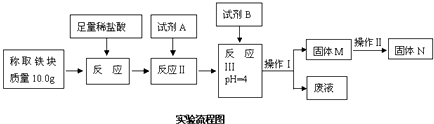
①试剂A应选择,试剂B应选择.
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②操作Ⅰ的名称为.固体M完全转化为固体N的标志是.
③已知常温下Fe(OH)3的KSP=4.0×10﹣38 , 求反应Ⅲ后溶液中c(Fe3+)=mol/L
④若最终红色粉末质量为14.14g,则该铁块的纯度是.如果直接洗涤、烘干和称量固体M的质量,计算铁块的纯度,则计算结果会(填“偏大”“偏小”或“无影响“).原因是.
-
(1) 某同学为研究该实验,查阅有关资料得到如下数据:
①该同学推测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?(填“合理”或“不合理”)
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用的试剂是,反应的离子方程式为.
③实验室溶解该熔融物,下列试剂中最好的是(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
-
(2) 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如图所示.
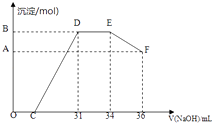
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为,上述现象说明溶液中、、结合OH﹣的能力比强(填离子符号).
③B点与A点的差值为摩尔.
-
(1) A克铝热剂中铝的物质的量为mol。
-
(2) A克铝热剂发中铝热反应,生成铁的质量为g。
-
(3) 计算该铝热剂中铝粉的质量分数(结果准确到0.1%)。
①Na2CO3—制水泥②SiO2—太阳能电池③AgI—人工降雨④MgCl2—制Mg⑤Al2O3—焊接钢轨⑥NaClO—消毒剂⑦H2SO4—制炸药⑧Na—制 Ti( )
|
W |
X |
|||
|
Y |
Z |
-
(1) 四种元素简单离子的半径由大到小为(用离子符号表达)。
-
(2) W的最简单氢化物的电子式为。
-
(3) W、X简单氢化物中沸点较高的是(填化学式)。
-
(4) Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为。
-
(5) 向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为。
-
(6) 分子式为C4H9Z的有机物其同分异构体有种。
-
(1) 利用铝热反应焊接钢轨的化学方程式为。
-
(2) 实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为。
-
(3) 乙醇与金属钠反应的化学方程式为。
-
(4) 苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为。
-
(5) 氯化铝溶液与氨水制备氢氧化铝的离子方程式为。
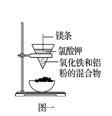 B . 图二:海水淡化的蒸馏操作中缺少了温度计
B . 图二:海水淡化的蒸馏操作中缺少了温度计 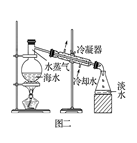 C . 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀
C . 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀  D . 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液
D . 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 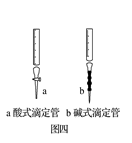
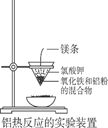
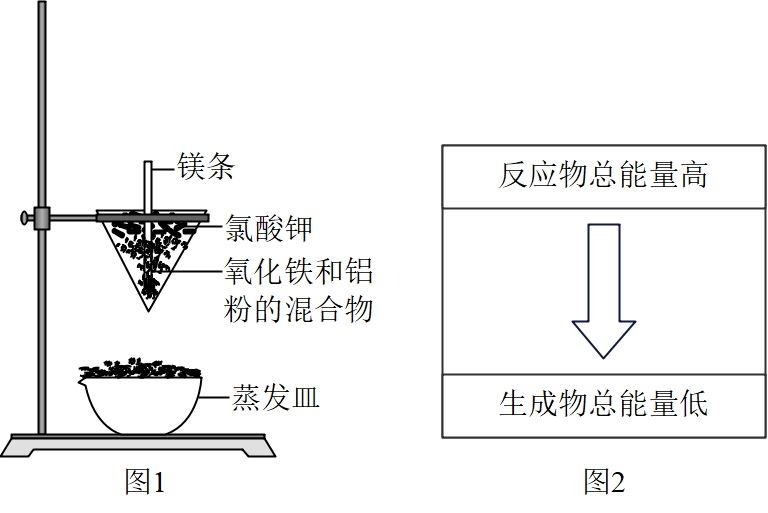
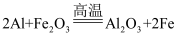 B . 工业上可用铝热反应的方法焊接钢轨
C . 在图反应过程中没有涉及到的化学反应类型是化合反应
D . 由图2可推出铝热反应是放热的反应
B . 工业上可用铝热反应的方法焊接钢轨
C . 在图反应过程中没有涉及到的化学反应类型是化合反应
D . 由图2可推出铝热反应是放热的反应
 Al2O3+2Fe,该反应为吸热反应
Al2O3+2Fe,该反应为吸热反应
-
(1) 用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:。
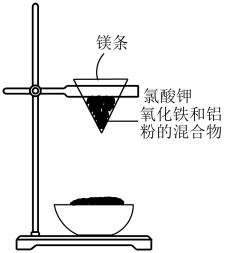
-
(2) 已知:Fe+2FeCl3=3FeCl2 , 利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液。该原电池中,三价铁离子向(填“正极”或“负极”)移动。负极的电极反应式为

-
(3) 古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法(只填一种方法)。



