无机物的性质实验 知识点题库
在一大试管中装入10mL NO,倒立与水槽中,然后向其中慢慢地通入6mL O2 , 下面有关实验最终状态的描述中,正确的是()
A . 试管内气体呈红棕色
B . 试管内气体无色,是NO
C . 试管内气体无色,是O2
D . 试管内液面下降
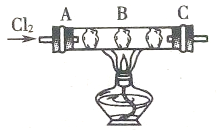
在硬质玻璃管中的A,B,C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的三个棉球(如图所示).向左端导入Cl2 , 在B处加热,可观察到A处棉球呈 色,B处棉球呈 色,C处棉球呈 色.将试管冷却后,在B,C之间的玻璃壁上有 色的 ,这是因为 .
下列关于Na2CO3和NaHCO3的性质的比较中,不正确的是( )
A . 热稳定性:Na2CO3>NaHCO3
B . 常温时的溶解度:NaHCO3<Na2CO3
C . 与相同浓度稀盐酸反应的剧烈程度:Na2CO3>NaHCO3
D . 等质量的固体与足量盐酸反应放出CO2的质量NaHCO3>Na2CO3
有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A . 溶液中水电离出的H+个数:②>①
B . 溶液中阴离子的物质的量浓度之和:②>①
C . ①溶液中:c(CO32﹣)>c(H2CO3)
D . ②溶液中:c(HCO3﹣)>c(H2CO3)
在硫酸铁溶液中,加入ag铜,完全溶解后,又加入bg铁,充分反应后得到cg残余固体,且b<c,则下列判断正确的是( )
A . 最后得到的溶液中不含有Fe2+
B . 残余固体可能为铁、铜混合物
C . 最后得到的溶液中只含Cu2+
D . 残余固体一定全部是铜
下表为25℃的三种弱酸的电离平衡常数:
|
化学式 |
HA(A代表某种酸根) |
HNO2 |
H2CO3 |
|
Ka |
Ka=4.9×10-10 |
Ka=4.6×10-4 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
-
(1) 用离子方程式表示NaNO2溶液呈碱性的原因。
-
(2) A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为。
-
(3) 写出NaA溶液中通少量CO2的离子方程式。
-
(4) 现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:

①如上图所示,试管④中装入的固体应该是(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更(填“强”或“弱”)。
请按要求填空做答。
-
(1) NaHCO3能用于治疗胃酸过多,反应的离子方程式为。
-
(2) 铁和水蒸气反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
-
(3) 制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,。
-
(4) 密度为1.84g/cm3 , 质量分数为98%的浓硫酸的物质的量浓度为。
某同学设计如下图所示装置(气密性已检查)制备Fe(OH)2白色沉淀。
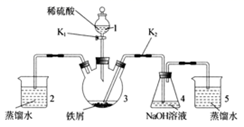
请填写下列空白:
-
(1) 仪器1的名称是。装置5的作用是。
-
(2) 实验开始时,关闭K2、打开K1 , 反应一段时间后,再打开K2、关闭K1 , 发现装置3中溶液不能进入装置4中。请改进装置,使溶液能进入装置4中:。
-
(3) 装置改进后,将装置3中反应后溶液压入装置4中,在装置4中立即析出白色絮状沉淀,迅速变为灰绿色,最终变为红褐色。请写出装置4中涉及到的化学方程式、,若始终没有观察到白色沉淀,从实验操作过程分析可能的原因是。
《本草图经》中对绿矾(FeSO4·7H2O)受热分解过程的描述为“绿矾形似朴消而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁……”。下列说法错误的是( )
A . 绿矾应隔绝空气保存
B . 该过程有氧化还原反应发生
C . “色赤如融金汁”说明有Fe2O3生成
D . 绿矾失去结晶水属于物理变化
化学与人类生活密切相关。关于下列物质的使用不合理的是( )
A . 二氧化硫常用于食品增白
B . 碳酸氢钠常用于焙制糕点
C . 醋酸常用于除去水壶内的水垢
D . 氢氧化铝常用于治疗胃酸过多
某盐 A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
-
(1) 写出红棕色固体 C 的化学式。
-
(2) 写出 A 受热分解反应的化学方程式。
-
(3) 写出气体 B 与溶液 E 反应的离子方程式。
“慈石能引铁”(慈,旧作磁)。“慈石”的主要成分是( )
A . Fe2O3
B . FeO
C . Fe3O4
D . Al2O3
下列有关实验装置、操作中不能实现相应实验目的的是( )
A . 证明氯气的氧化性强于碘  B . 证明在氢氧化钠的乙醇溶液中加热溴乙烷时有乙烯生成
B . 证明在氢氧化钠的乙醇溶液中加热溴乙烷时有乙烯生成  C . 制备氨气
C . 制备氨气  D . 比较Ksp(AgCl)、Ksp(AgBr)的相对大小
D . 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 
 B . 证明在氢氧化钠的乙醇溶液中加热溴乙烷时有乙烯生成
B . 证明在氢氧化钠的乙醇溶液中加热溴乙烷时有乙烯生成  C . 制备氨气
C . 制备氨气  D . 比较Ksp(AgCl)、Ksp(AgBr)的相对大小
D . 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 
下列说法错误的是( )
A . 可利用  溶液水解法制备氢氧化铁胶体
B .
溶液水解法制备氢氧化铁胶体
B .  的“喷泉实验”说明
的“喷泉实验”说明  能大量、快速地溶于水
C . 氯仿(
能大量、快速地溶于水
C . 氯仿( 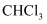 )与HF反应生成的
)与HF反应生成的 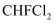 有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代
有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代
 溶液水解法制备氢氧化铁胶体
B .
溶液水解法制备氢氧化铁胶体
B .  的“喷泉实验”说明
的“喷泉实验”说明  能大量、快速地溶于水
C . 氯仿(
能大量、快速地溶于水
C . 氯仿( 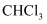 )与HF反应生成的
)与HF反应生成的 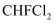 有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代
有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代
化学与生活密切相关,下列叙述正确的是:( )
A . 向煮沸的NaOH溶液中滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液变为红褐色,可制取Fe(OH)3胶体
B . 石英能用于生产光导纤维,高纯硅可以制芯片、CPU等半导体
C . 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D . 84消毒液和75%的酒精杀菌消毒的原理相同
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
-
(1) 向步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有(填离子符号),检验滤液中还存在Fe2+的方法为。(说明试剂、现象)
-
(2) 步骤②加入过量H2O2的目的是。
-
(3) 步骤③中反应的离子方程式为。
下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A . A
B . B
C . C
D . D
探究金属铜与过量浓硫酸反应的装置(固定装置已略去)如图所示。关于实验操作或现象述不正确的是( )

A . 上下抽动铜丝,可控制反应随时发生或停止
B . c装置中黑色固体变为红色
C . e中可以选用NaOH溶液或酸性KMnO4溶液
D . 其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同
下列叙述不正确的是( )
A .  、
、 、
、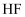 的稳定性依次增强
B .
的稳定性依次增强
B . 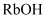 、
、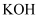 、
、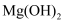 的碱性依次减弱
C . 微粒半径:
的碱性依次减弱
C . 微粒半径: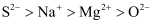 D .
D .  、
、 、
、 酸性依次增强
酸性依次增强
 、
、 、
、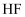 的稳定性依次增强
B .
的稳定性依次增强
B . 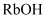 、
、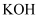 、
、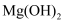 的碱性依次减弱
C . 微粒半径:
的碱性依次减弱
C . 微粒半径: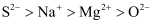 D .
D .  、
、 、
、 酸性依次增强
酸性依次增强
下列实验能达到目的的是。( )
选项 | 目的 | 实验 |
A | 除去Cl2中的HCl气体 | 将混合气体通入盛有饱和食盐水的洗气瓶 |
B | 检验加碘食盐中的KIO3 | 向加碘食盐水中滴加淀粉溶液 |
C | 用Cu制备CuSO4 | 将Cu与稀硫酸混合 |
D | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加NaOH溶液 |
A . A
B . B
C . C
D . D
最近更新



