无机物的性质实验 知识点题库
绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
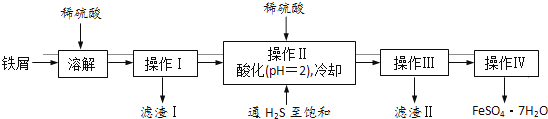
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
-
(1) 通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+ , 其反应的离子方程式为 ;操作Ⅱ,在溶液中用硫酸酸化至pH=2的目的是 .
-
(2) 操作IV的顺序依次为: 、过滤、洗涤、干燥.
-
(3) 操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② .
-
(4) 操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② .
-
(5) 测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.滴定时发生反应的离子方程式为:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O).
①用硫酸酸化的0.01000mol•L﹣1KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
②判断此滴定实验达到终点的方法是 .
③若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 .
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.
(1)A中制取Cl2的离子方程式 .
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究.
①提出合理假设.
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 .
②设计方案,进行实验.写出实验步骤以及预期现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
|
步骤2:向A试管中滴加适量BaCl2溶液. | |
步骤3: |
|
(3)已知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为 .

-
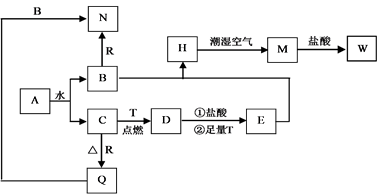
(1) 写出下列物质的化学式
ADR
-
(2) 按要求写下列反应方程式
H在潮湿空气中变成M的化学方程式
D与盐酸反应的离子方程式
实验目的 | 实验方法 | |
A | 确认Fe(OH)3胶体是否制备成功 | 用可见光束照射 |
B | 确认铜与浓硫酸反应生成CuSO4 | 向反应后混合液中加水 |
C | 确认钠与水反应生成NaOH | 向反应后混合液中滴加酚酞 |
D | 确认Cl2无漂白作用 | 将有色纸条放入干燥Cl2中 |
| A | B | C | D |
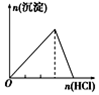
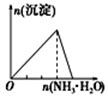
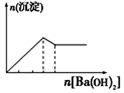
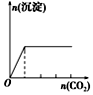
| 向NaAlO2溶液中逐滴滴加盐酸至过量 | 向AlCl3溶液中逐滴滴加氨水至过量 | 向明矾溶液中逐滴滴加 Ba(OH)2溶液至过量 | 向澄清石灰水中缓缓通入CO2至过量 |
| | | | |
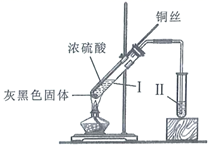
 B . 反应结束后,为观察溶液颜色需向试管Ⅰ中加入水
C . 若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色
D . 为验证气体产物具有还原性,试管Ⅱ可盛放溴水
B . 反应结束后,为观察溶液颜色需向试管Ⅰ中加入水
C . 若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色
D . 为验证气体产物具有还原性,试管Ⅱ可盛放溴水
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
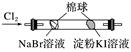
| B | | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
3NO2+H2O=2HNO3+NO (第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2 , 工业上通常把生成的NO再次氧化为NO2 , 再次用水吸收
2NO+O2=2NO2 (第一次通O2)
3NO2+H2O=2HNO3+NO (第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2 , 如果按上述方法进行循环氧化吸收:
-
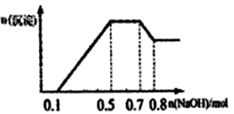
(1) 则第二次吸收后,NO2的总吸收百分率为(可以用分数表示,下同),第二次通入O2的体积为升,第三次吸收后还剩余NO升。
-
(2) 第n次吸收后剩余NO的体积为升(用含n的代数式表示)。
-
(3) 如果要使3升NO2恰好完全转化为HNO3 , 则需通入O2的总体积为升。
(所有气体体积均在相同条件下测定)
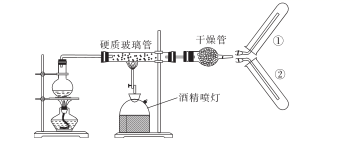
 C . 干燥管中加入的固体干燥剂可以是无水氯化钙
D . 收集反应产生的气体选用装置②
C . 干燥管中加入的固体干燥剂可以是无水氯化钙
D . 收集反应产生的气体选用装置②
选项 | 劳动项目 | 化学知识 |
A | 社区服务:回收旧衣物并进行分类 | 棉、麻和丝主要成分均为纤维素 |
B | 家务劳动:用热的纯碱溶液去除餐具的油污 | 碳酸钠溶液显碱性 |
C | 校内劳动:用稀硝酸处理做过银镜反应的试管 | 硝酸具有强氧化性 |
D | 学农活动:利用豆科植物作绿肥进行施肥 | 豆科植物可实现自然固氮 |
化学性质 | 实际应用 | |
A | Fe粉具有还原性 | 可用于防止食品氧化变质 |
B | NaHCO3受热分解有气体生成 | 可用作焙制糕点的膨松剂 |
C | 二氧化硅导光能力强 | 可作太阳能电池板 |
D | BaSO4难溶于水和酸 | 可在医疗上用作“钡餐”透视 |
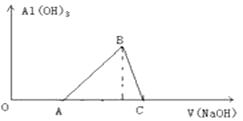
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤MgO
 等杂质)为原料制备绿矾晶体的工业流程如图。
等杂质)为原料制备绿矾晶体的工业流程如图。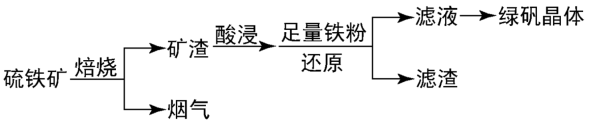
下列有关说法中错误的是( )