结晶的概念与方法 知识点题库
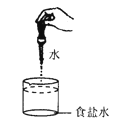 B .
B . 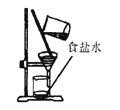 C .
C . 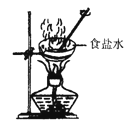 D .
D . 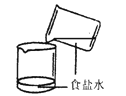
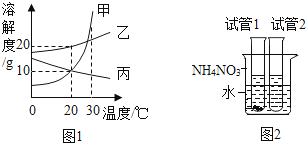
图1是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
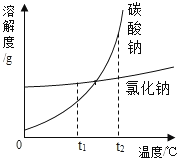
淮安市某盐化厂生产的碳酸钠粗产品中含有少量氯化钠.碳酸钠和氯化钠的溶解度与温度的关系如图所示,回答下列问题:
(1)t1℃时碳酸钠与氯化钠中溶解度较大的物质是 .
(2)t1℃时碳酸钠溶液升温至t2℃,所得溶液的溶质质量分数 .(填“变大”、“变小”或“不变”).
(3)除去碳酸钠中混有少量氯化钠的方法是 .
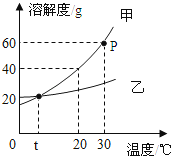
如图是甲、乙两种固体物质的溶解度曲线.据图回答:
(1)P点的含义 .
(2)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有(写出一种),当甲中含有少量乙时,可采用的方法提纯甲.
(3)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为 . 若烧杯内物质升温到50℃(不考虑蒸发),溶液中变化的是 (选填序号).
a.溶质的质量 b.溶液的质量 c.溶质的质量分数
(4)从图中还可获得的信息是 (答出一条).
如图是A、B、C三种固体物质在水中的溶解度曲线图,请回答下列问题:
(1)t1℃时A物质的溶解度是 克.
(2)当A物质中混有少量B物质吋,通常可采用的方法提纯A物质.
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂的质量不变),三种溶液中溶质的质量分数由大到小的顺序是 (填字母).


-
(1) 物质结晶主要有两种方法,从海水中晒盐主要是利用了蒸发溶剂的方法,还有一种结晶的方法叫.
-
(2) 某盐农将10吨海水引入盐田,设海水中含盐的质量分数约为3%,当晒干后,该盐田理论上可得盐多少千克?
-
(3) 下表为食盐的溶解度表,据表分析:
在50℃时,向100克水中加入50克食盐,充分搅拌后所得溶液质量为克.
温度(℃)
10
20
30
40
50
60
70
食盐溶解度(克)
35.8
36.0
36.3
36.4
37.0
37.3
37.8
-
(1) 乙醇(沸点为78℃)和水混合物的分离;
-
(2) 从食盐水得到食盐;
-
(1) 向50毫升水(密度为1克/毫升)中溶解一定量硝酸钾(KNO3)固体的操作如下,请根据如图实验现象及溶解度曲线回答问题。

①A、B、C中一定是饱和溶液的是,一定是不饱和溶液的是;(填字母)
②当x=克时,B中恰好没有固体剩余;
③硝酸钾从溶液中析出晶体常用的方法。
-
(2) 根据下列仪器,欲配制一定质量分数的食盐溶液,回答下列问题。
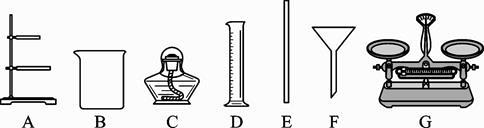
①上面的仪器中除D、E外,还必须选用的仪器有(填字母);
②E的作用是,配制的步骤可以概括为计算、称取和量取、、装瓶贴标签。
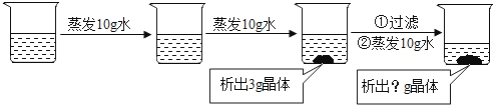
-
(1) 硝酸钾和氯化钾的溶解度受温度影响较大的是,一般可采用 的方法使之结晶。
-
(2) t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是。
 Na2CO3+CO2↑+H2O)。
Na2CO3+CO2↑+H2O)。

-
(1) 循环中物质X的化学式。
-
(2) 将所得滤液(NH4Cl与NaCl的混合溶液)浓缩后降温,NH4Cl晶体大量析出,NaCl却仍留在了溶液中,主要原因是。
-
(1) 如图,海水淡化可缓解淡水资源匮乏的问题,水在该过程中不发生变化的是 (填字母)。
 A . 分子间隔 B . 分子种类
A . 分子间隔 B . 分子种类 -
(2) 人们通过晒盐从海水中获得氯化钠晶体,这种结晶方法叫,利用这种结晶法是因为氯化钠的溶解度。
 B .
B .  C .
C .  D .
D . 
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
|
溶解度/g |
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
|
氯化钾 |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
|
-
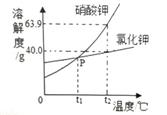
(1) 60℃时,将45g氯化钠和40g氯化钾分别放人100g水中充分搅拌,所得氯化钠溶液溶质的质量分数氯化钾溶液溶质的质量分数(选填“<<”“>”或“=”)。
-
(2) 若氯化钾固体中含有少量氯化钠固体,可采用获得氯化钾晶体。

-
(1) 在向热水添加碳酸钠粉末的过程中,若观察到现象, 则乙溶液已饱和。
-
(2) 乙丙溶液的溶质的质量分数分别为a、b,则a、b的大小关系为。
-
(3) 实验结束后,若回收丙烧杯中的固体。你会选择上图中的哪个装置,并说明理由。



