二氧化碳的工业制法 知识点题库
下列关于产生氧气方法的叙述中,错误的是( )
A . 空气中的氧气主要来自于植物的光合作用
B . 工业上用分离液态空气的方法制取氧气是分解反应
C . 用含有氧元素的物质发生反应才有可能产生氧气
D . 用过氧化氢溶液制氧气时不加二氧化锰也能产生氧气
下列说法正确的是( )
A . 自然界产生氧气的途径是绿色植物的呼吸作用
B . 工业上用液态空气制氧气,发生了分解反应
C . 实验时制取氧气通常选择某些含氧元素的物质分解
D . 氧气用于炼钢、气焊和气割,这是利用了氧气的可燃性
称取某石灰石样品20g在高温条件下充分煅烧(杂质不反应),称得剩余固体为13.4g,求该石灰石样品中CaCO3的质量分数.(提示:石灰石的主要成分为碳酸钙,碳酸钙高温分解的化学方程式为CaCO3 CaO+CO2↑ )
CaO+CO2↑ )
高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.
①若10g碳酸钙全部分解可产生多少克氧化钙?
②实际反应生成的二氧化碳是多少克?
工业上煅烧125t石灰石(主要成分是CaCO3)可制得56t氧化钙,则所用石灰石中碳酸钙的质量分数为多少?(化学方程式为CaCO3  CaO+CO2↑)
CaO+CO2↑)
 CaO+CO2↑)
CaO+CO2↑)
工业上利用高温煅烧石灰石(主要含CaCO3)的方法制取二氧化碳,.即是在高温条件下使其分解生成氧化钙(CaO)和二氧化碳.若想制取二氧化碳88t,请计算:需要CaCO3含量为80%的石灰石的质量至少为多少?(杂质不参与反应)
下列事实能用同一原理进行解释的是( )
A . 金和铝在空气中都不易被腐蚀
B . 实验室收集CO2和O2都能用向上排空气法
C . 实验室和工业上都可用石灰石制二氧化碳
D . 在滴有酚酞的NaOH溶液中滴加稀盐酸和投入活性炭都能使溶液褪色
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图所示)。
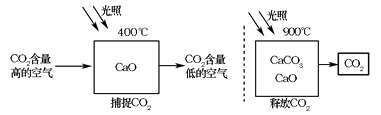
某化学小组的同学对此 非常感兴趣,在老师的指导下,设计了如图装置探究上述设想的反应原理是否可行。
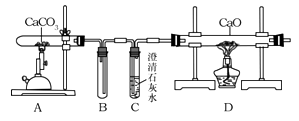

某化学小组的同学对此 非常感兴趣,在老师的指导下,设计了如图装置探究上述设想的反应原理是否可行。

-
(1) 能证明装置A“释放出CO2”的现象是;
-
(2) 装置B在实验结束撤掉酒精喷灯时的作用是
-
(3) 上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2。
【资料卡片】氧化钙和水反应生成氢氧化钙,此反应放出大量的热。氢氧化钙是一种微溶于水的白色粉末。
【猜想与假设】D中的固体可能为:I.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙。
【进行实验】①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,认为猜想Ⅲ成立。
乙同学认为甲同学实验不足以证明猜想Ⅲ成立,其原因是。
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热。乙同学据此认为试管中的固体有氧化钙,即猜想I成立。
③丙同学认为乙同学的实验不够严谨,于是向D物质中加稀盐酸,再结合乙同学的结论,完成了下面的实验报告后,得出猜想Ⅱ成立的结论。
实验步骤
实验现象
实验结论
猜想Ⅱ成立
-
(4) 通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。该设想的优点有__________(填字母序号)。A . 原料易得 B . 充分利用太阳能 C . 释放出的CO2可作为资源加以利用
-
(5) 请写出上述实验过程中的任何一个化学方程式:。
下列除去杂质的方法错误的是( )
选项 | 物质 (括号内为杂质) | 除杂方法 |
A | N2 ( O2 ) | 通过灼热的铜网 |
B | CaO ( CaCO3 ) | 高温煅烧 |
C | CO2 ( CO ) | 点燃 |
D | H2 ( 水蒸气 ) | 通过浓硫酸 |
A . A
B . B
C . C
D . D
中国诗词既蕴含人文思想,又焕发着理性的光辉,以下对下列划线部分的化学解释不合理的是( )
A . 花气袭人知骤暖 , 喜鹊穿树喜新晴——温度高,分子运动加快
B . 千锤万凿出深山,烈火梦烧若等闲——煅烧石灰石,不发生化学变化
C . 美人首饰侯王印,尽是沙中浪底来——金的性质稳定,在自然界中以单质形态存在
D . 何意百炼钢 , 化为绕指柔——生铁经不断煅烧捶打氧化,含碳量降低变成钢
下列四个图象能正确反映其对应实验操作的是( )
A . 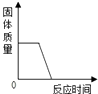 高温煅烧一定质量的石灰石
B .
高温煅烧一定质量的石灰石
B .  用等质量、等浓度的双氧水分别制取氧气
C .
用等质量、等浓度的双氧水分别制取氧气
C . 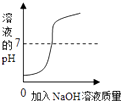 向一定体积的水中逐滴加入氢氧化钠溶液
D .
向一定体积的水中逐滴加入氢氧化钠溶液
D .  某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
 高温煅烧一定质量的石灰石
B .
高温煅烧一定质量的石灰石
B .  用等质量、等浓度的双氧水分别制取氧气
C .
用等质量、等浓度的双氧水分别制取氧气
C .  向一定体积的水中逐滴加入氢氧化钠溶液
D .
向一定体积的水中逐滴加入氢氧化钠溶液
D .  某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
下列四个图像分别与选项中的操作相对应,其中合理的是()
A . 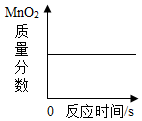 加热
加热 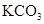 和
和 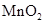 的混合物制取
的混合物制取 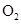 B .
B . 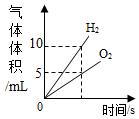 将水通电电解一段时间
C .
将水通电电解一段时间
C . 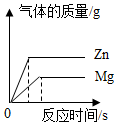 等质量的
等质量的 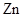 粉和
粉和 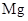 粉分别加入足量的稀盐酸中
D .
粉分别加入足量的稀盐酸中
D . 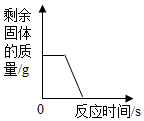 煅烧一定质量的石灰石
煅烧一定质量的石灰石
 加热
加热  将水通电电解一段时间
C .
将水通电电解一段时间
C .  等质量的
等质量的  煅烧一定质量的石灰石
煅烧一定质量的石灰石
A~F 是初中化学常见的5种物质,分别由C、H、O、Ca中的一种或几种元素组成。已知A的固体可用于人工降雨;B是可燃性气体,燃烧能生成A;化合物D、E、F中含有相同的金属元素,且存在如下转化关系:D→E→F→A。
请回答下列问题:
-
(1) A的另一种用途是。
-
(2) B中一定含有的元素是。
-
(3) D→E的化学方程式是。
-
(4) F→A的化学方程式是。
如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题:

-
(1) 欲在实验室中制备并收集干燥的二氧化碳气体。
①所选仪器的连接顺序为(填写仪器序号字母)。
②仪器A中,发生反应的化学方程式为。
③若向G装置中倒入适量澄清石灰水,迅速用预先绑有小气球的橡皮塞塞紧,振荡,观察到的气球出现的现象是。
-
(2) 欲用混有少量二氧化碳的一氧化碳气体还原氧化铁,所选仪器的连接顺序为:混合气体→D→B→C。进行实验时,D装置玻璃管中的现象是。
下列四个图像能正确反映其对应实验操作的是( )
A . 高温煅烧石灰石制取生石灰 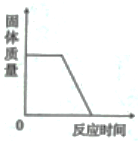 B . 用两份等质量、等浓度的过氧化氢溶液分别制取氧气
B . 用两份等质量、等浓度的过氧化氢溶液分别制取氧气  C . 向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液
C . 向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液  D . 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
D . 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 
 B . 用两份等质量、等浓度的过氧化氢溶液分别制取氧气
B . 用两份等质量、等浓度的过氧化氢溶液分别制取氧气  C . 向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液
C . 向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液  D . 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
D . 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 
工业上利用高温煅烧石灰石制取生石灰(CaO)和二氧化碳。已知充分煅烧10t石灰石可生成3.52t二氧化碳,求此石灰石中所含CaCO3的质量分数。
工业上利用高温煅烧石灰石制取CaO和二氧化碳。请计算充分煅烧10t含CaCO380%的石灰石,可制得CaO的质量是多少?
石灰石是一种常见的矿物,其主要成分为碳酸钙.它在工农业生产和实验室均有重要的应用.探究小组利用石灰石开展如下实验.根据要求回答问题:
-
(1) 实验Ⅰ:制取二氧化碳.实验室有如图1仪器装置供选择.
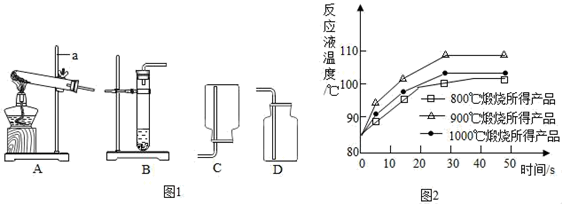
仪器a的名称是.
-
(2) 制取和收集CO2时,应选择装置和;制取的化学方程式是.
-
(3) 实验过程中,为检验集气瓶中二氧化碳是否收集满,所采取的实验方法为(含操作、现象和结论).
-
(4) 实验Ⅱ:煅烧石灰石,检验分解产物.
煅烧石灰石的化学方程式为.
-
(5) 取适量产物与足量水充分反应后静置,取上层清液通入CO2 , 观察到清液,即可证明产物中含氧化钙.CO2通入清液中,所发生反应的化学方程式为.
实验Ⅲ:研究不同温度下煅烧石灰石所得分解产物氧化钙的活性.
-
(6) 已知:生石灰的活性受煅烧温度影响;生石灰活性越高,其化学反应能力越强.探究小组取三份等质量的石灰石样品,分别于800℃、900℃和1000℃条件下煅烧15分钟,并将煅烧所得的三份固体产物分别加入到盛有等质量水(足量)的三个烧杯中,测得烧杯内反应液的温度随时间的变化如图2所示.由此可推知:
①CaO与水反应热量(填”放出“或”吸收“;℃煅烧所得Ca活性最高.
②实验时,需要控制煅烧温度、石灰石样品质量、水的用量以及.
碳及含碳物质有如下图所示转化关系,说法错误的是( )
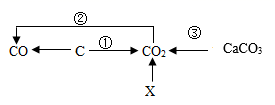
A . X可以是酒精
B . 反应①中C一定是还原剂
C . 反应②一定是化合反应
D . 反应③一定是与稀盐酸反应
我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
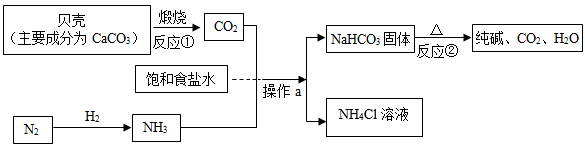
-
(1) 操作a的名称是。
-
(2) 反应①的化学方程式是。
-
(3) 饱和食盐水中通入CO2前先通入NH3的目的是。
最近更新



