探究金属锈蚀的条件 知识点
探究金属锈蚀的条件 知识点题库
 的实验
C . 探究影响物质溶解性因素的实验
D . 小花用紫色的石蕊探究CO2和水反应的实验
的实验
C . 探究影响物质溶解性因素的实验
D . 小花用紫色的石蕊探究CO2和水反应的实验
如图是同学们经常使用交通工具﹣﹣自行车,请完成下列各题:

-
(1) 所标各部件中由金属材料制成的是(填序号),属于有机合成材料的有(任选一种物质填序号).
-
(2) 车轮的钢圈在潮湿的空气中会锈蚀,这是铁与空气中的和水蒸气等物质发生化学反应的结果.通常用盐酸除铁锈,该反应的化学方程式为;
-
(3) 新型食品保鲜剂“纳米α铁粉”被称为“双吸剂”,其实质就是利用了铁生锈的原理,若用化学方法检验使用一段时间的“纳米α铁粉”是否完全失效,可选用检验,若出现的现象,说明该双吸剂仍可使用.

-
(1) 优化实验时将Ⅰ中自来水换为蒸馏水目的是.
-
(2) 优化实验时增加Ⅳ是为证明铁生锈与空气中的(填化学式)有关,
-
(3) 实验Ⅴ在软塑料瓶中完成的,一周后可观察到铁钉生锈,,同时铁钉靠近水边附近部分锈蚀得厉害.由此可知:铁生锈实际是铁与(填化学式)共同作用的结果.
-
(4) 实验Ⅵ还可用来完成(填实验名称).

-
(1) 图1是水通电分解的示意图,请写出电解水的化学方程式,若试管a中产生10 mL气体,则相同条件下,b试管中产生mL气体。
-
(2) 图2中生成有刺激性气味的气体,该气体(填“属于”或“不属于”)空气污染物;试验结束后,用pH试纸测量集气瓶中的液体,其pH7(填“小于”、“等于”或“大于”)。
-
(3) 图3所示的是探究铁生锈条件的实验,一段时间后发现c中铁片变红,d中铁片依然光亮,对比c、d中的现象,说明决定铁生锈快慢的一个重要因素是:。
-
(4) 防止温室效应的进一步增强,以下建议可行的是(填字母) 。A . 开发太阳能、水能、风能、地热等新能源 B . 禁止使用煤、石油、天然气等矿物燃料 C . 大量植树造林,禁止乱砍滥伐 D . 禁止使用空调

-
(1) 甲是实验室粗盐提纯中蒸发结晶的实验。仪器a的名称是。结晶过程中,当时,停止加热。
-
(2) 乙是探究铁钉生锈条件实验。在ABC三个实验中,能够证明铁钉生锈需要水的实验是(选填实验序号)
-
(3) 丙是实验室用高锰酸钾制取氧气的装置。该装置中有一处错误的是;该反应方程式为。
 验证质量守恒定律
B .
验证质量守恒定律
B .  测定空气中氧气含量
C .
测定空气中氧气含量
C .  探究铁钉锈蚀的条件
D .
探究铁钉锈蚀的条件
D .  探究燃烧条件之一:温度达到着火点
探究燃烧条件之一:温度达到着火点
-
(1) 初中化学有许多实验,若按照实验方法分类,可将实验①(填字母)分为一类;分类的依据是②;
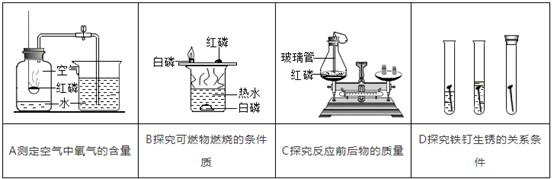
-
(2) 初中化学中我们已经学过了氧化物,若根据性质分,可以把氧化物分为:酸性氧化物和碱性氧化物等,其中酸性氧化物指的是:能与碱反应生成盐和水的氧化物叫酸性氧化物。反应过程中各元素的化合价不变,如P2O5就是酸性氧化物。请写出P2O5与氢氧化钠溶液反应的化学方程式①。氧化铜是一种碱性氧化物,请根据氧化铜与酸反应的生成物,推测碱性氧化物的定义是②。
-
(1) 人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属的位置移到最后,正好符合由弱到强的金属活动性顺序。
图1

图2
 图3
图3 
-
(2) 铝、铁、铜是我们生产生活中使用比较广泛的金属。如图1所示用品中,利用金属导热性的是,延展性的是(填字母序号)。
-
(3) 某小组用图2所示装置对铁生锈的条件进行探究。4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是
-
(4) 铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和共同作用的结果。
-
(5) 合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。如表是一些金属的熔点数据。
金属
铜
锌
锡
铅
铋
镉
熔点/℃
1083
419.6
231.9
327.5
271.3
320.9
①铅锡合金中某种金属的质量分数与合金的熔点有如图3所示的关系,其中横坐标表示的是的质量分数;当合金熔点最低时,合金中铅与锡的质量比为。
②保险丝由铋、铅、锡、镉组成,其熔点约为。
A.15~30℃
B.60~80℃
C.235~250℃
D.300~320℃。
(查阅资料)铜锈的主要成分为Cu2(OH)2CO3。
-
(1) (作出猜想)铜生锈可能与空气中的氧气有关外,还可能与有关,作出此猜想的依据是。
-
(2) (实验设计)兴趣小组同学取4根铜丝设计了如下图所示的四个实验。
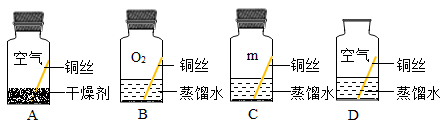
他们为了除去铜丝表面的污物,实验前应该做的操作是。C瓶中的m应该是。
-
(3) (现象分析)若干天后,发现只有D瓶中的铜丝表面出现绿色的铜锈,其他瓶中的铜丝表面均无铜锈出现。
①实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是。
②通过B瓶与D瓶中的现象对比,可以得出铜生锈与有关的结论。
-
(4) (实验结论)由上述四个实验可以分析得出猜想成立,写出铜生锈的化学方程式。
-
(5) (讨论交流)在同样环境下银丝依旧光亮如新,原因是。

-
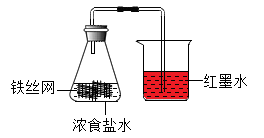
(1) CaCl2的作用是。
-
(2) 为保证实验成功,实验前需进行的一项操作是。
-
(3) 一周后,两支具支试管中的现象分别是,玻璃管中红墨水的变化是。
| 实验装置 | 序号 | 其他试剂 | 100s时O2的含量 |
| | ① | 干燥剂 | 21% |
| ② | 10滴水 | 15% | |
| ③ | 10滴水和1.0g食盐 | 8% |

-
(1) 甲装置中仪器a的名称是;该装置作为气体发生装置对反进物状态和反应条件的要求是。
-
(2) 乙是探究影响铁锈蚀快慢因素的实验,为探究氯化钠是否可以加快铁的锈蚀,试管①中的物质X和试管②中的物质Y分别是。
-
(3) 丙是粗盐提纯实验中的过滤操作。过滤时,最好先将上层液体倒入过滤器,然后再倒入混有沉淀的液体,以免,使过滤速度过慢。在粗盐提纯实验中,若倾倒液体时液面高于滤纸边缘(其他操作均正确)。则得到的精盐质量会(选镇 “偏大”“不变”或“偏小”)。

-
(1) 探究长期放置在空气中的铜表面生锈,生成“铜绿”(化学式:Cu2(OH)2CO3)的原因。
【查阅资料】碱石灰能吸收二氧化碳和水蒸气,氢氧化钠溶液能吸收二氧化碳。
【设计实验】
序号
a
b
c
d
实验装置

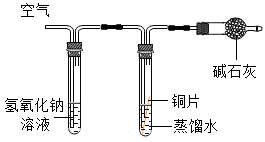


实验现象
铜片不生锈
铜片不生锈
铜片不生锈
铜片生锈
【得出结论】①说明铜生锈需要水的一组实验是(填实验序号);
②通过实验证明铜与H2O和反应产生“铜绿”。
③碱石灰的作用是。
-
(2) 探究CuO和氢气的反应产物
【查阅资料】氧化亚铜为红色固体,溶于氨水得到蓝色溶液。
【进行实验】实验①,如图1所示实验装置,进行氢气还原氧化铜实验并检验固体产物。

实验②:称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原,其在不同时间(t)所得固体中Cu2O的质量(m)如图2所示。
【实验结论】取实验①反应后的红色固体于烧杯中,加入氨水并搅拌,观察到,证明固体产物有Cu2O。
-
(3) 【实验反思】兴趣小组认为,氢气还原氧化铜的反应过程主要为“经历
 ,
,  两个反应,且在同一条件下两个反应同时进行”。请结合实验结果和计算分析,说明“在同一条件下两个反应能同时进行”合理的依据:。
两个反应,且在同一条件下两个反应同时进行”。请结合实验结果和计算分析,说明“在同一条件下两个反应能同时进行”合理的依据:。
-
(4) 探究硫酸铜溶液与铝反应的产物
【进行实验】兴趣小组同学在试管中进行如图3所示的实验,实验中发生反应的化学方程式是:。

实验过程中,小组同学惊奇的发现试管中铝片表面有气泡生成,并收集了该气体。
【提出问题】生成的气体是什么呢?
【猜想与假设】猜想1:可能是SO2;猜想2:可能是H2;……
【实验探究】甲同学用手轻的在盛有该气体的试管口煸动,使极少量的气体飘进鼻孔,发现该气体无气味,认为猜想1不成立,其原因是。乙同学在甲同学实验的基础上,接着进一步实验,验证该气体为H2。
-
(5) 【解释和结论】铝片表面生成的少量气泡为H2 , 硫酸铜溶于水后,会发生如下变化:
①CuSO4在水中解离出Cu2+和
 ;
;②
 。
。铝片和H+会发生如下变化:
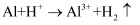
【拓展延伸】材料1:硫酸铝溶于水也会发生类似的变化。
材料2:在一定条件下,氢氧化铝具有吸附性,可吸附水里的悬浮杂质。
根据以上信息,请解释硫酸铝也可以用来净水的原因:。
-
(1) Ⅰ.锈蚀条件探究
同学们设计了图1所示实验进行探究。
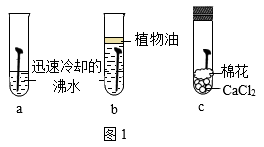
设计b试管实验的目的是创设的实验环境。
-
(2) 根据一周后ac试管不同的现象可以得出的结论是。
-
(3) 一周后b试管中铁钉也出现明显锈蚀。同学们对此展开深入研究。将煮沸冷却后的蒸馏水倒入烧杯中,迅速倒入植物油铺满水面。然后将溶解氧传感器插入水中,通风环境中持续三天采集得到数据图像如图2所示(室温下,自然状况的水中溶解氧约为8~9mg·L-1)。
据此回答:

①b试管中出现锈蚀的原因是。
②欲达到原实验目的,写出一种b试管实验的改进设计:。
③在铁制品表面涂植物油能防锈的原因是。
-
(4) Ⅱ.锈蚀成分探究
【查阅资料】铁锈成分复杂,化学式可简单表示为Fe2O3·nH2O。Fe2O3·nH2O加热后容易分解产生水蒸气。
【设计方案】甲同学设计了图3(夹持仪器已省略)所示实验方案,同学们讨论后认为该方案设计有明显缺陷,你对方案修改完善的建议是

【进行实验】将ab试管中的生锈铁钉取出晾干,刮下部分铁锈放入玻璃管中。按完善后的装置进行实验(每步反应和吸收均完全)。实验过程测得以下数据:
装置A的总质量m1(不包括酒精喷灯)
装置B的总质量m2
装置C和装置D的总质量m3
加热前
516.20g
463.00g
252.60g
加热后
513.44g
464.80g
255.29g
【实验分析】
①根据以上数据可得,该铁锈的化学式可简单表示为。
②实验过程中,以下操作会导致n的测量数值偏大的是。
A.停止加热后马上敞口称量装置A总质量
B.加热前没有排空气就称量装置B总质量
C.m3仅仅称量了加热前后的装置C总质量
D.A中反应刚结束就称量装置C、D总质量
 B . 探究铁钉生锈需要氧气
B . 探究铁钉生锈需要氧气 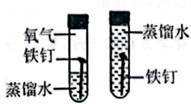 C . 验证质量守恒定律
C . 验证质量守恒定律  D . 证明二氧化碳的密度比空气大
D . 证明二氧化碳的密度比空气大 
-
(1) 一、为探究燃烧的条件,某同学进行如图所示的实验:

实验Ⅰ能验证可燃物燃烧需要氧气的现象是。
-
(2) 设计实验Ⅱ的目的是。
-
(3) 铜片上的红磷没有燃烧的原因是。
-
(4) 实验中水的作用是。
-
(5) 二、蜡烛燃烧前后质量的测定。
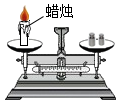
该实验(填“能”或“不能”)用于验证质量守恒定律,在此过程中燃烧掉的蜡烛质量(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
-
(6) 三、结合下列实验回答有关问题
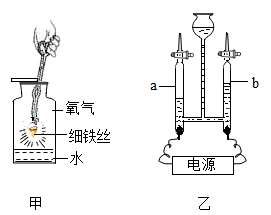

实验甲集气瓶中放少量水的目的是。
-
(7) 实验乙a玻璃管中收集到的气体是。
-
(8) 实验丙对比一段时间后三枚铁钉生锈程度,可以得出铁生锈的条件是。
-
(9) 四、“粗盐中难溶性杂质的去除”实验操作的主要步骤如图。

操作A的名称为。
-
(10) 操作C中玻璃棒的作用是。
-
(11) 该实验正确的操作顺序为(填字母)。




