探究金属锈蚀的条件 知识点题库
探究学习了铁生锈的条件后,小明同学对铜制眼镜框表面出现的绿色物质产生了兴趣,他也想探究:铜是在什么条件下产生绿色物质的呢?通过学习化学知道该绿色物质叫作“铜绿”,主要成分是Cu2(OH)2CO3;小明猜想:铜生锈可能与空气中的某些成分有关。 于是设计了如下图所示的实验:
一段时间后,看到B试管中铜片生锈,其余试管中铜片均不生锈。请你总结:铜生锈的条件是 与 、 、的共同作用。
如果C试管中铜片换为无锈洁净的铁钉,结果是 。
序号 | ① | ② | ③ | ④ |
实验内容 |
|
|
|
|
实验现象 | 铁钉无明显变化 | 铁钉生锈 | 铁钉无明显变化 | 铁钉生锈,U型管左侧液面上升,右侧液面下降 |
-
(1) 通过实验①、②对比得出的结论是.
-
(2) 增加实验③的目的是.
-
(3) 实验④中,导致“U型管左侧液面上升,右侧液面下降”的原因是
-
(1) 一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿).铜绿化学式是Cu2(OH)2CO3 , 它受热会分解生成三种氧化物.
青铜器属于 (填序号).
A . 无机材料 B . 合成材料 C . 复合材料 D . 复合肥 -
(2) 铜绿分解的化学方程式为.
-
(3)
为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如图1所示(所用铜片洁净、光亮,试管内的“
 ”为铜片).
”为铜片).
实验较长时间后,发现(填试管编号)试管中铜片最先生锈.小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验.你认为要补充的一个实验是:Cu和(写出试管中需要的物质).可以省略不做的实验是试管(填试管编号).
-
(4) 二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2
 2Cu+SO2
2Cu+SO2方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,你认为哪种方法更好,原因是(写出1条原因即可).辉铜矿的主要成分为Cu2S,常用于火法炼铜.若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿t(取整数).
-
(5)
三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等.工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42﹣、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如图2:

加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用(填序号).
a.Fe2O3 b. CaCO3 c.CuO
-
(6) 加入Na2CO3沉淀前须除去Fe3+ , 否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O
=2NaFe3(OH)6(SO4)2+6CO2↑+5.
-
(7)
加入Na2CO3沉淀时,反应液pH对产品中的SO42﹣含量以及反应液中Cu2+沉淀效率的影响如图3所示,第二次沉淀时溶液pH最好控制在.

-
(8)
所制得的碱式碳酸铜的组成可表示为:xCuCO3•yCu(OH)2•zH2O.某研究小组设计如图4实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响).

实验步骤如下:①连接装置并;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172mL.
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是,少量植物油的作用是,C中的试剂是(填字母序号); a.碱石灰 b.浓硫酸 c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管(填“缓慢上移”或“缓慢下移”).
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L.根据实验数据计算产品中CuCO3的质量分数(写出计算过程) .(保留到0.1%)
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是 (填字母序号);
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油
D.步骤⑥中没有调节量气装置两边液面相平,直接读数
-
(9)
碱式碳酸铜【xCuCO3•yCu(OH)2•zH2O】的热分解研究.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如图5.

(已知Cu(OH)2的分解温度小于CuCO3的分解温度.)
Ⅰ.通过计算可得x:y:z=;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:.


-
(1) 实验I是“探究吸入空气和呼出气体的成分有什么不同”时的一组实验,根据伸入呼出气体中的小木条先熄灭的现象,得出的结论是。
-
(2) 在实验Ⅱ中,由铜片上的白磷燃烧而红磷不燃烧的事实,得出燃烧需要的条件是;实验完毕,将烧杯中的热水慢慢倒出,当白磷刚露出水面便剧烈燃烧起来,原因是;请写出白磷燃烧的化学方程式。
-
(3) 实验Ⅲ是“探究铁的锈蚀条件”中的一组对比实验,该实验的目的是探究铁生锈的条件之一是,其中试管②中的水带要事先煮沸,目的是。
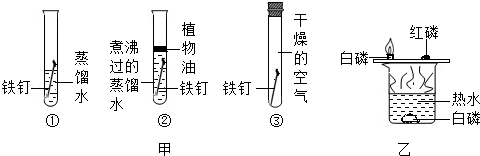
 B . 比较铁、钢、银的金属活动性顺序
B . 比较铁、钢、银的金属活动性顺序  C . 探究铁钉生锈的条件
C . 探究铁钉生锈的条件  D . 探究燃烧的条件
D . 探究燃烧的条件 
-
(1) 铁锅手柄上使用的塑料应具有性(填“热塑”或“热固”)。
-
(2) 高炉炼铁中原料焦炭的作用是为燃烧提供热量和 (用化学方程式表示)。
-
(3) 如图所示,将铁片放入盛有水的烧杯中,放置一段时间后,可观察到试管内液面上升,产生该现象的原因是。

|
序号 |
样品 |
量筒起始 读数/mL |
量筒最终 读数/mL |
所需时间 /min |
|
1 |
1g铁粉、0.2g碳和10滴水 |
100 |
70 |
约120 |
|
2 |
lg铁粉、0.2g碳、10滴水和少量NaCl |
100 |
70 |
约70 |
|
3 |
_____ |
100 |
70 |
约480 |
-
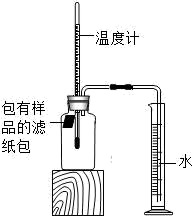
(1) 实验①和②说明NaCl可以铁锈蚀的速率。
-
(2) 实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是(填“放热”或“吸热”)过程。
-
(3) 实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是。
-
(4) 已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。
-
(5) 该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是(小数点后保留1位)。


-
(1) 实验①和②说明NaCl可以铁锈蚀的速率。
-
(2) 实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是(填“放热”或“吸热”)过程。
-
(3) 实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是。
-
(4) 已知碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。
-
(5) 该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是(小数点后保留1位)。
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
|
编号 |
① |
② |
③ |
④ |
⑤ |
|
实验 |
| | | | |
| 现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
-
(1) 实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
-
(2) 得出“铜生锈一定与O2有关”的结论,依据的两个实验是(填编号)。
-
(3) 对比实验①和③,得出的结论是。
-
(4) 为验证猜想,实验⑤广口瓶中除铜丝外,还应有的物质是。
-
(5) 由上述实验可推知,铜生锈的条件是。
-
(6) (反思与应用)
结合上述实验,你对保存铜制品的建议是。
-
(1) 工业上用一氧化碳与赤铁矿来炼铁的化学方程式为,该反应中(填化学式)发生了氧化反应。
-
(2) 钢铁制品表面喷漆可有效防止与空气中的(填化学式)接触而生锈。
-
(3) 锰钢的主要成分是锰、铁、碳,可用于制造钢轨。如图所示,将两块大小相同的锰片、铁片分别放入甲、乙两支试管中,一段时间后取出,发现只有甲试管的锰片表面有固体析出,则金属活动性 MnFe(填“>”或“<”)。谭松同学认为将甲、乙两试管中的硫酸锌溶液换成等体积、等浓度的,通过观察现象,也可比较 Mn 和 Fe 的活动性强弱。

| 选项 | A | B | C | D |
| 实验目的 | 探究水对铁钉生锈的影响 | 探究温度是燃烧的必要条件 | 探究金属活动性强弱 | 探究催化剂对反应快慢的影响 |
| 实验设计 | | | | |
 B . 防止铁钉生锈
B . 防止铁钉生锈  C . 探究 NaOH 溶解时的热变化
C . 探究 NaOH 溶解时的热变化  D . 制取并收集氢气
D . 制取并收集氢气 

认识铁的腐蚀
-
(1) 下列环境中铁制品最容易生锈的是()
A 擦干的铁锅 B 盛水的不锈钢水杯 C 浸泡在海水中的铁栏杆
-
(2) 铁与氧气、水等反应生成的铁锈,因此铁制品可以全部锈蚀。
探究铁的腐蚀
-
(3) 该小组用图甲装置进行实验,起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面处在约(40或10)mL刻度处,原因是:。

-
(4) 接着,小组的同学用图乙装置进行了如下实验:取铁钉用砂纸打磨,称其质量,按图乙安装装置,放置三天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加如下表。
温度/℃
10
20
30
40
50
60
70
铁钉质量增加/g
0.02
0.04
0.08
0.16
0.18
0.18
0.18
他们探究的是对铁钉腐蚀快慢的影响,结论是。
-
(5) 有的同学认为该小组同学的实验未能真实反应50℃后铁钉腐蚀的快慢,理由是铁钉的质量没有变化。请分析铁钉质量没有变化的原因可能是。
-
(6) 请你列举在生活中防止铁腐蚀的具体方法:。
![]()
-
(1) ①中发生反应的化学方程式可以是。
-
(2) ②中,铁钉主要与空气中的氧气、发生反应。
-
(3) 如果用a、b、c分别代表光亮铁钉,锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序是(用字母表示)。
-
(1) 实验步骤一:取a克上述生铁样品放入一洁净干燥烧杯中,进行如下实验。
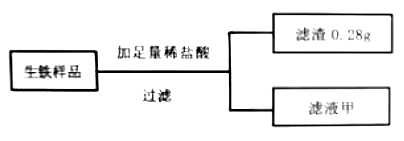
生铁出现锈蚀现象的原因是。
-
(2) 实验中所得滤渣需要用蒸馏水洗涤、干燥后再称量,确定滤渣已经洗涤干净的方法是。滤液甲在以下实验中已不需要,将其倒入废液缸。
-
(3) 实验步骤二:另取a克该生铁样品,进行如图所示实验,实验装置气密性良好。
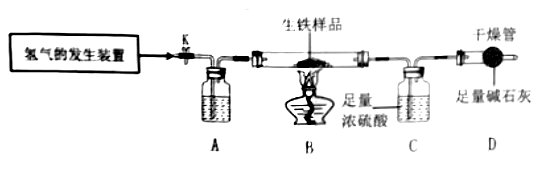
A装置瓶中盛放的试剂是。(填物质名称)
-
(4) 为防止装置内氢气不纯,加热时可能发生爆炸,实验前要打开弹簧夹K,先通入一会儿氢气,再点燃酒精灯加热,待完全反应后,熄灭酒精灯,冷却至室温,关闭弹簧夹K。确定装置内氢气已经纯净的方法是,实验结束后,C装置内浓硫酸的质量增加了0.54克。
-
(5) 实验步骤三:小组同学取实验步骤二中B装置硬质玻璃管内反应后所得全部黑色粉末进行了如下实验,所用装置和滤渣已略去,
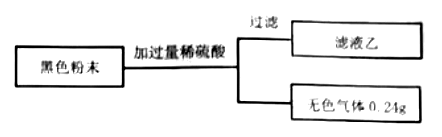
通过以上实验可得出,生铁中己锈蚀的铁的质量是,生铁粉末锈蚀前的含碳量是,有同学认为,由上述实验得出的已锈蚀的铁的质量可能存在误差,理由是。
-
(6) 实验小组取部分滤液乙于烧杯中,加入一定质量的镁粉,充分反应后过滤,将滤渣洗涤、干燥,所得滤渣的质量与加入镁粉的质量相等,则所取溶液中参加反应的溶质的质量比是。(填最简整数比)
 甲:头发被带电的气球吸引,说明头发原来一定带电
B .
甲:头发被带电的气球吸引,说明头发原来一定带电
B .  乙:两个铅柱没有被重物拉开,说明分子之间存在引力
C .
乙:两个铅柱没有被重物拉开,说明分子之间存在引力
C .  丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关
D .
丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关
D .  丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素
丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素

















