金属活动性顺序及其应用 知识点题库
(1)保护金属资源的有效途径除了合理有效地开采矿物、寻找金属代用品外,还有 . (只填一个即可)
(2)如果把金属x放入硝酸银溶液中,过一会儿在x表面有银析出,则x和银相比,金属活动性较强的是 .
(3)日常生活中用得较多的和合成纤维都是重要的有机合成材料.


-
(1) 下列铜制品中,利用金属导热性的是(填字母序号)。

-
(2) 古时,铜为国之重器。铜和铁的使用先后顺序是。
-
(3) 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu,由硫酸铜溶液置换所得),并得到硫酸锌溶液,主要流程如图图所示(反应条件已略去):

已知:2Cu+2H2SO4+O2=2CuSO4+2H2O
①过程I中,能否不用O2?,理由是。
②过程Ⅱ中,物质B是,如何判断物质B已经足量; 反应方程式:; 分离操作的名称是,所用玻璃仪器为:。
③过程III中,物质D是。
④A~E中含铜、锌两种元素的有(填字母序号)。
-
(1) 人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属的位置移到最后,正好符合由弱到强的顺序。
-
(2) 汽车车体多用钢材制造。表面不仅美观,而且可有效防止生锈。
-
(3) 工业冶炼金属:
①工业上用CO还原赤铁矿冶炼金属铁的化学方程式为。工业冶铁的原料有石灰石、铁矿石、空气及焦炭,其中焦炭的作用有、;石灰石首先在高温下发生分解,其化学反应方程式为;其分解产物与铁矿石的杂质结合成炉渣。
②中国古老的冶铜方法“湿法冶铜”主要的反应原理是(写化学方程式)。
-
(4) 在实验室中探究铝、铜、银的金属活动性顺序,除铝、银外,还需要用到的试剂是。(填化学式)
-
(5) 铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图。

①使用铁锅是利用金属的,
②家庭用的燃料大多为天然气,写出天然气燃烧的化学方程式。炒菜时铁锅中的油着火可用锅盖盖灭,其原理是。
③铜也易生锈,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],是铜与空气中的共同作用的结果。
-
(1) 铁是年产量最高的金属,也是人体中不可缺少的微量元素,饮食中常用的调料——铁强化酱油,主要目的是为了预防。
-
(2) 近年来,我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:

①图中标识的物质,属于金属材料的是(写出一种即可)。
②使用铝合金做内筒的优点是(写出一点即可)。某品牌饮料的空易拉罐应收入(填“可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的发生化学反应的过程;用稀盐酸除锈会生成氯化铁和水,试写出此反应的化学方程式。
-
(3) 将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是(填字母)。
A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若滤渣中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3−
C 若滤液为浅绿色,则滤渣中一定含银、铜、铝
D 若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+ , 可能有Ag+
-
(1) 在Cu和Zn中,活动性较强的是;
-
(2) Cu与AgNO3溶液的反应中,离子变成了原子;
-
(3) 只用少量的盐酸、一支试管和锌、铜、铝,通过加入金属的顺序不同,也能验证这三种金属的活动性的强弱,则加入的顺序为(假设每次的反应均反应完全)。

下列说法中错误的是( )

-
(1) 在四川三星堆遗址出土大量重要文物,其中有巨青铜面具如图甲,其制作材料属于______(填序号)。A . 金属材料 B . 合成材料 C . 复合材料
-
(2) 为了防止铁器生锈,通常在其表面涂防护漆,其防锈原理是。
-
(3) 某同学用图乙所示实验来验证铜与银的金属活动性强弱,则X、Y分别是,其反应的化学方程式是。
-
(1) 国人为之骄傲的第一艘国产航母于2017年4月26日在大连下水。
①铜运用于航母的电力系统是利用了铜的 性。
②合金是航母的主体材料,如铝合金,在航母制造中备受青睐。常温下,单质铝在空气中不容易被锈蚀的原因是(用化学方程式表示) ;
③航母外壳用涂料覆盖,是为了防止钢铁材料与 接触而锈蚀。
-
(2) 在做金属化学性质探究实验时:
①已知金属A和B能够发生如下反应:Zn+ACl3=ZnCl2+A、B+ZnCl2=BCl2+Zn,判断Zn、A、B三种金属的活动性由强到弱依次是在ZnCl2中,锌、氯元素的质量比为 ;
②在硝酸铜和硝酸银的混合溶液中,加入一定量铁粉,使之充分反应后,过滤,向所得滤渣中加入适量稀盐酸,没有气体产生,则滤渣中一定有 (填化学式,下同),可能有;

-
(1) 出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜(填“强”或“弱”)。
-
(2) 古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(
 ),二硫化亚铁铜中铁元素和硫元素的质量比为。
),二硫化亚铁铜中铁元素和硫元素的质量比为。
-
(3) 应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素(元素种类相同)原子,它们的主要区别是不同。(填微粒名称)
-
(4) 如图是金的元素周期表图,请试写出有关金元素的一条信息。


-
(1) 图中“操作①”的名称是。该操作中用到的玻璃仪器有。
-
(2) 滤液A中除水之外的主要成分的物质名称是。
-
(3) 写出所得贵重金属中任意一种成分的化学式。
-
(4) 任写一个①中发生的化学方程式。
-
(1) 一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。选择铸造硬币的材料时需要考的因素是____(填序号)。A . 金属的导电性 B . 金属的耐腐蚀性 C . 金属的硬度 D . 金属价格与硬币面值的吻合度
-
(2) 铁、铜是我们生活中常见的金属。某工厂利用废铁丝、硫酸铜废液(含硫酸亚铁)和废锅粉制备硫酸铜晶体。具体过程如下:

①处理过的废铁丝投入到硫酸铜废液里发生反应的化学方程式为。
②过量废铁丝与硫酸铜废液充分反应后,为了得到纯净的铜粉,Ⅰ的主要步骤是向反应所得混合物中加入过滤。
③在“氧化铜”(含少量铜)转化为硫酸铜溶液的过程中,以下化学反应方程式与该过程有关的是。
A.
 B.
B.
C.
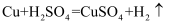 D.
D.



