固体溶解度曲线及其作用 知识点
固体溶解度曲线及其作用
固体溶解度曲线就是用纵坐标表示溶解度(用字母 S 表示,单位为克/g),横坐标表示温度(用字母 t 表示,单位为℃),根据物质在不同温度时的溶解度不同,画出的物质溶解度随温度变化的曲线。
固体溶解度曲线的作用可从点、线、面和交点四方面来理解。具体如下:
1.点,溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。
溶解度曲线上的点有三个方面的作用: (1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.线,溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰。(2)根据溶解度曲线,判断或比较某一物质在不同温度下的溶解度大小。 (3)根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并且,还可以判断或比较析出晶体的质量大小(即曲线越陡,析出的晶体就越多)。
3.面,对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。
4.交点,两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
固体溶解度曲线及其作用 知识点题库
小华同学进行了以下四个实验,并用图像分别记录了实验过程中的现象,其中不正确的是( )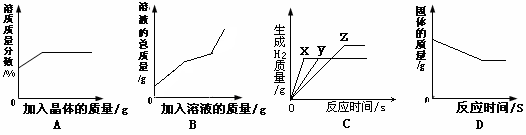
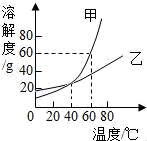
如图为甲、乙两种固体物质的溶解度曲线(水的密度约为1g/cm3).
(1)两种物质中,溶解度受温度影响更大的是(填“甲”或“乙”).
(2)20℃时,乙的溶解度为 .
(3)下列实验中:10mL水 X
X Y
Y Z为饱和溶液的是(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是(用“<”或“>”或“=”表示出来)
Z为饱和溶液的是(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是(用“<”或“>”或“=”表示出来)

20℃时,将等质量的甲、乙两种物体分别加入盛有100g水的烧杯中,充分搅拌后现象如图(a)所示,加热到50℃时现象如图(b)所示,甲、乙两物质的溶解度曲线如图(C)所示。请结合图示判断,下列说法错误的是( )


(a) (b) (c)

-
(1) 由X、Y两种物质的溶解度曲线可判断,溶解度受温度影响较小的是.
-
(2) 40℃时,把30g的X加入50g水中,充分溶解,得到该温度下X的水溶液是(填“饱和”或“不饱和”)溶液.
-
(3) 60℃时,在等量水中分别加入一定量的X、Y两种物质至恰好饱和时,所得溶液质量大小关系为:XY(填“>”或“=”或“<”).


-
(1) 30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为;
-
(2) 要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是;
-
(3) 50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是,所得溶液中溶质质量分数最小的是

-
(1) 现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为g;配制的主要步骤有:计算、称量、溶解、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、、玻璃棒和试剂瓶。
-
(2) 甲、乙、丙三种物质的溶解度曲线如图所示,据图回答:
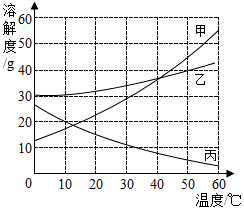
①30℃时,三种物质的溶解度由大到小的顺序为;
②要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是;
③50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是。

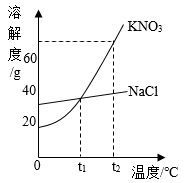
A.t2℃时,100gb的饱和溶液中含有b物质25g
B.t3℃时,分别将等质量的a、b饱和溶液降温至t2℃,析出的固体质量关系是:a>b
C.分别将t1℃时a、c的饱和溶液升温到t2℃,均变为不饱和溶液
D.a中含有少量b时,可采用的方法提纯a

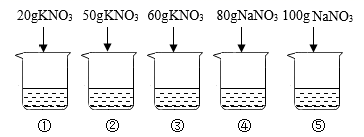
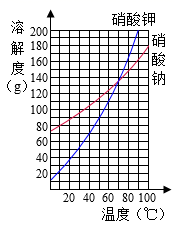
下列温度中,KNO3比NaNO3 溶解度大的是( )


-
(1) “保证实验安全”是进行试验的重要原则。实验时不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,不要惊慌,应立刻用。
-
(2) 据如图回答下列问题。

①请写出试管A中发生反应的方程式。
②关于实验的下列说法,正确的是(选填字母)。
A金属网罩的作用是集中火焰提高温度
B若反应前加入的木炭过量,生成的气体还有一氧化碳
C实验结束后,试管A中固体减少的质量为氧元素的质量
-
(3) 如图是甲、乙、丙三种固体的溶解度曲线。

①40℃时,甲物质的溶解度(填“>”、“<”或 “=”)丙物质的溶解度。该温度下,甲物质的饱和溶液的溶质质量分数为。(计算结果精确到0.1%)
②20℃时,分别取相同质量的甲、乙、丙饱和溶液于烧杯中,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列关于升温后溶液说法一定正确的是(填序号)。
A乙溶液是饱和溶液B乙固体逐渐减少至全部溶解
C丙固体逐渐增多D乙、丙溶液的溶质质量分数相同
③40℃时,实验室要将70g甲的饱和溶液稀释成10%的溶液。

计算:需加水体积为mL。
量取:若采用如图1所示的操作来量取水的体积(其他操作均正确),则所得溶液的溶质质量分数(选填“>”、“<”或“=”)10%。


-
(1) 在℃时,甲和丙的溶解度相等。
-
(2) t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为g。
-
(3) t3℃时,将125g丙的饱和溶液降温至t1℃,应再加入g丙才能恰好达到饱和状态。




