固体溶解度曲线及其作用 知识点题库
下图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中不正确的是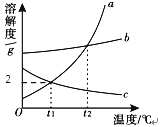
A . t1℃时,60 g a的饱和溶液中含有溶剂50 g
B . t2℃时,a、b两物质的饱和溶液中溶质质量分数相等
C . 若a中混有少量的b,可用降温结晶法提纯a
D . 升高温度可使c的饱和溶液变为不饱和溶液
甲、乙两种固体的溶解度曲线如图所示.下列说法中,正确的是( )
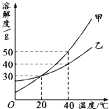
A . 甲的溶解度大于乙的溶解度
B . 20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
C . 40℃时,分别在100 g水中加入40g 甲、乙,所得溶液溶质的质量分数相等
D . 分别将甲和乙的饱和溶液从40℃降低到20℃,甲会析出晶体,乙则不会
四川遂宁境内的卓筒井是手工制盐的活化石,被誉为“中国古代第五大发明”、“世界石油钻井之父”,不仅是古代劳动人民勤劳、智慧的象征,也造福了千秋万代.其工艺流程如图1所示包括下面五个步骤:
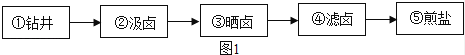
请结合所学化学知识,回答下列问题:
-
(1) 第②步汲出的卤水浑浊,浓度一般在7~10度(即溶质质量分数为7%~10%,下同),这样的卤水咸度低,耗燃料,成本高,为了把卤水浓度提高到18~20度,就产生了“晒卤”这一环节.在“晒卤”的过程中溶液溶质质量分数 (填“不变”、“变大”或“变小”).
-
(2) 第④步“滤卤”和实验室“过滤”的原理一样,都是为了除去液体中的不溶性杂质.在实验室的过滤操作中,必须用到的玻璃仪器有:烧杯、玻璃棒、 ,其中玻璃棒的作用是 .
-
(3) 第⑤步“煎盐”和实验室 结晶(填结晶的方法)的原理相同.
-
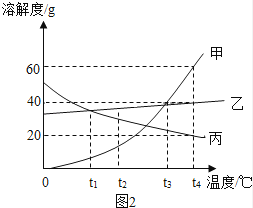
(4) 如图2所示是甲、乙、丙三种物质的溶解度曲线图,据图2回答下列问题:
Ⅰ.甲、乙两种物质在 ℃时溶解度相同.
Ⅱ.t2℃时,甲、乙、丙三种物质溶解度由大到小排列为 .
Ⅲ.t4℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种能形成饱和溶液,则a的取值范围是 .
甲、乙、丙三种固体物质的溶解度曲线如图所示.下列说法正确的是( )
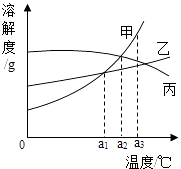
A . 把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液
B . a2℃时,丙的溶液的质量分数大于乙的溶液的质量分数
C . 三种物质的溶解度都随温度的升高而增大
D . a3℃时,三种物质的溶解度大小关系:甲>丙>乙
如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )
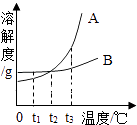
A . A的溶解度都大于B的溶解度
B . t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大
C . t2℃时,A、B两种饱和溶液中,溶质的质量分数相等
D . A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等质量
能够用结晶法分离的是( )
A . 食盐和矿石
B . 硝酸钾和氯化钠
C . 酒和水
D . 铜粉和铁粉
甲、乙两种固体的溶解度曲线如右图所示.下列说法中,不正确的是( )
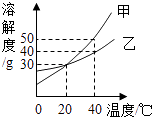
A . 20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
B . 40℃时,分别在100g水中加入40g甲、乙,所得溶液溶质的质量分数相等
C . 40℃时,分别在100g水中加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D . 20℃时,分别在100g水中加入40g甲、乙,加热到40℃时,乙溶液为饱和溶液
如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
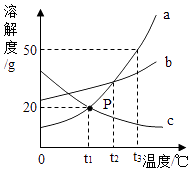
-
(1) 三种物质的溶解度随着温度升高而减小的是.
-
(2) t2℃时,物质a的溶解度与物质的相等.
-
(3) t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是溶液(填“饱和”或“不饱和”).
-
(4) t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是 (填字母序号).A . a>b B . a=b C . a<b D . 不能确定.
如图甲是A,B,C三种固体物质的溶解度曲线图.
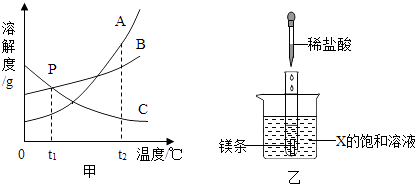
-
(1) 甲图中,t2℃时,A,B,C三种物质中,溶解度最大的是,P点所表示的含义为.
-
(2) ①将t2℃时A,B,C三种物质的饱和溶液降温到t1℃时三种物质的溶质质量分数由大到小的顺序是;
②如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种?.
如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述正确的是( )

A . t1℃时,等质量的甲、乙溶液中所含溶质的质量为乙>甲
B . t2℃时,20g丙能溶解于50g水中形成70g溶液
C . 若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D . 分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
甲、乙两种不含结晶水的固体的溶解度曲线如图所示.下列说法中正确的是( )

A . t3℃时,甲的饱和溶液溶质与溶液的质量比为1:2
B . t1℃时,甲的溶解度大于乙的溶解度
C . t2℃时,甲、乙溶液的溶质质量分数都为30%
D . t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙的质量
t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( )
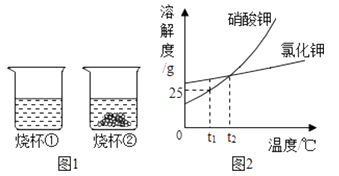
A . 烧杯①的溶液一定是不饱和溶液
B . 烧杯①的溶液是硝酸钾溶液
C . t1℃时烧杯②的溶液的溶质质量分数为25 %
D . 若烧杯①和烧杯②的溶液都升温到t2℃时,两种溶液的溶质质量分数相等
如图是3种物质的溶解度曲线。下列叙述正确的是( )
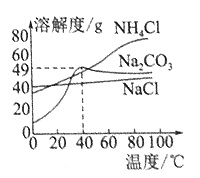
A . 0℃时,NaCl的溶解度小干NH4Cl的溶解度
B . 40℃时,饱和Na2 CO3溶液的溶质质量分数为49%
C . 将饱和Na2 CO3溶液由80℃冷却至40℃时,有固体析出
D . 80℃时,分别将等质量的NH4Cl和NaCl固体溶于适量的水,恰好均配成饱和溶液,所得溶液的质量前者小于后者
a、b、c三种固体物质的溶解度曲线如图所示,下列有关叙述正确的是( )
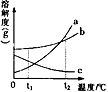
A . a物质的溶解度大于b物质的溶解度
B . t2℃时,c溶液溶质质量分数最小
C . 将t1℃时a的饱和溶液升高温度后,溶质质量分数变大
D . 大量b中混入少量a,一般用蒸发溶剂的方法获得较纯净的b
如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法确的是( )

A . t1℃时,将a、b两物质的饱和溶液分别恒温蒸发等质量的水,析出的晶体的质量一定相等
B . t2℃时a溶液的质量分数一定小于b溶液的溶质质量分数
C . 若a中混有少量b,可以降温结晶的方法提纯a
D . 将t2℃时b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
A,B两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
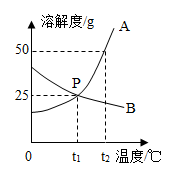
A . 恒温蒸发溶剂的方法不可以使B得到饱和溶液析出晶体
B . 将t2℃时A、B的饱和溶液分别降温至t1℃,A成为不饱和溶液
C . t2℃时,用等质量的 A、B分别配制成饱和溶液,所得溶液的质量A>B
D . .t2℃时,将150g A的饱和溶液稀释成质量分数为20%的溶液,需水100g
如图是甲、乙、丙三种固体物质的溶解度曲线,且它们溶于水时溶液温度均无明显变化.回答下列问题:
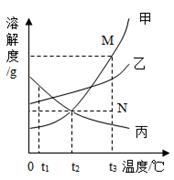
-
(1) 丙物质的溶解度随温度升高为(填“增大”或“减小”)
-
(2) t1℃时,三种物质的溶解度大小顺序为.
-
(3) t2℃时,等质量的甲、乙两种物质的饱和溶液中溶剂的质量大小关系为甲乙(填“>”、“<”或“=”).
-
(4) 若甲物质中混有少量的丙物质,可采用的方法提纯甲.
-
(5) 若要将组成N点的甲溶液转变为M点的甲溶液,可以采用的方法是__.
关于如图所示实验的相关判断错误的是( )

A . 固体X可能是NaOH
B . 固体X可能是NH4NO3
C . Ca(OH)2溶解度:①>②
D . Ca(OH)2质量分数:①=③
下图为甲、乙、丙三种固体物质的溶解度曲线,请回答。
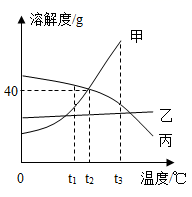
-
(1) t1℃时,甲、乙、丙三种物质的溶解度大小关系是。
-
(2) 甲中混有少量乙,若要提纯甲,可采取的结晶方法是。
-
(3) t2℃时,将50g丙物质放入100g水中充分溶解,所得溶液中溶质和溶液的质量比为(填最简整数比)。
-
(4) t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的质量由大到小的顺序是。
如图为氯化钠和碳酸钠的溶解度曲线,下列说法正确的:( )
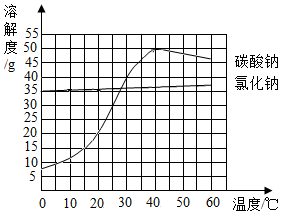
A . 氯化钠的溶解度大于碳酸钠的溶解度
B . 碳酸钠的溶解度随温度的升高而增大
C . 20℃时向50g水中加入20g氯化钠可形成70g溶液
D . 40℃时150g碳酸钠饱和溶液降温至30℃可析出晶体
最近更新



