酸的化学性质 知识点题库
-
(1) 【提出猜想】
猜想一:溶质是CaCl2和Ca(OH)2
猜想二:溶质是CaCl2
猜想三:溶质是CaCl2和 .
-
(2) 【查阅资料】
①CaCl2溶液呈中性;
②有关的化学反应:
a.氢氧化钙溶液和稀盐酸进行中和反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O
b.碳酸钠溶液和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
c.碳酸钠溶液和氯化钙溶液反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl
【实验设计与验证】
(1)小猛同学设计用无色酚酞溶液验证“猜想一”是否成立.取少量上述实验中烧杯里的溶液于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到溶液不变色.于是可以确定“猜想一”(填“成立”或“不成立”),其理由是 .
(2)小华同学设计用碳酸钠溶液验证“猜想二”和“猜想三”是否成立.取少量上述实验中烧杯里的溶液于试管中,并向试管中逐滴加入过量的碳酸钠溶液,观察到的现象是:先出现气泡,后有生成.于是可以确定成立.
-
(3) 【交流与反思】
经过同学们讨论和交流,发现只需用下列一种物质就能验证得出以上三种猜想中的哪一种猜想成立,请在下列物质的选项中选择出你认为合理的物质是 (填序号).
A.锌粒 B.紫色石蕊溶液 C.二氧化碳.
某化学兴趣小组用如图所示装置研究以下两个问题.
【实验1】可燃物燃烧的条件
步骤1:水槽中放有一定量热水,水面下a处放一小块白磷,此时观察到白磷不燃烧.
步骤2:在乙中放入二氧化锰和过氧化氢溶液,立即将甲倒扣在乙上.此时观察到甲中水面下降,白磷露出水面, .此实验运用对比的方法研究了可燃物燃烧的一个条件是 .
【实验2】浓盐酸的性质
步骤1:a处放一湿润的紫色石蕊试纸,乙中放入浓盐酸,立即将甲倒扣在乙上.此时观察到试纸变为红色.说明浓盐酸具有的性质为 .
步骤2:将试纸取出,立即向水槽中加入滴有酚酞的氢氧化钠溶液,此时观察到红色溶液逐渐变为无色.出现此现象的原因是 .

水龙头是常见的生活用品,如图是一款水龙头的示意图,请用化学用语填空:

-
(1) 所标物质中属于金属单质的是;
-
(2) 劣质水龙头采用铁作为主体替代不锈钢,这种铁制水龙头易生锈,可用稀盐酸除锈,铁锈在稀盐酸中反应后溶液呈黄色,是因为溶液中含有(填离子符号),写出该反应的化学方程式.(图中小字是不锈钢手柄,全铜直角.)
-
(1) 每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟空气中的和共同作用的结果;铁也能在酸性溶液中被腐蚀,写出铁与稀硫酸反应的化学方程式:.
-
(2) 为了防止钢铁锈蚀,人们常采用的方法(任写一种)来达到目的.
-
(3) 铁锈的主要成分是Fe2O3 , 用盐酸可以除去铁锈.写出盐酸除铁锈的化学方程式:.
-
(1) 实验步骤:①在第一只试管中加入月2毫升蒸馏水,滴入几滴紫色石蕊溶液,观现象.
②在第二支试管加入约2毫升NaCl溶液滴入几滴紫色石蕊溶液,观察现象
③在第三支试管中加入约2毫升稀盐酸溶液,滴入几滴紫色石蕊溶液,观现象
实验1现象:,你得出结论是.
实验2现象,说明Cl﹣
实验3现象,你得出结论是
-
(2) 探究二探究酸和碱能否发生反应
梦阳向试管中加入2毫升NaOH溶液,滴入几滴酚酞溶液,溶液显红色,然后她又用滴管连续滴入一定量的稀硫酸,溶液有红色为无色,说明酸和将能发生反应(反应方程式),大家对梦阳得到的无色溶液继续探究.李阳认为恰好中和,反应后溶液中的溶质只有Na2SO4 , 你认为对吗?,原因.同学们根据以下2种方案进行实验后,反应后溶液中的溶质有2种,请你补填下表的空缺.
操作
现象
结论
方案1:取少许反应后溶液置于试管中,向其中加入
有2种溶质
方案2:取少许反应后的溶液置于试管中,向其中加入
结论:酸和碱可以发生反应,反应的微观实质.
-
(3) 探究三.熟石灰变质的探究
熟石灰露置在空气中,得到的白色固体可能是Ca(OH)2 , 也可能是CaCO3 , 你认为白色固体可能是.请你设计实验证明你的猜想(填下表)
①取固体加入水中过滤,滤液滴加溶液
滤液变红,说明固体中有
②滤渣加观察
滤渣有气泡,说明固体中有.
根据①②现象确定你的猜想是正确的.


参考资料:SiO2既不溶于水也不与酸反应
-
(1) 反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为;
-
(2) 残渣中除金属锌外,还有;
-
(3) 操作一、操作二和操作三采用的分离方法是;
-
(4) 操作四发生反应的化学方程式为
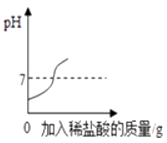 向pH=13的氢氧化钠溶液中加入稀盐酸
B .
向pH=13的氢氧化钠溶液中加入稀盐酸
B .  向一定质量表面生锈的铁片中滴加盐酸至过量
C .
向一定质量表面生锈的铁片中滴加盐酸至过量
C .  等质量的锌粉和铁粉与足量的稀硫酸反应
D .
等质量的锌粉和铁粉与足量的稀硫酸反应
D . 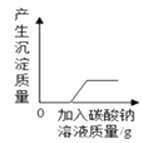 向含有HCl和CaCl2的混合溶液中加入Na2CO3溶液
向含有HCl和CaCl2的混合溶液中加入Na2CO3溶液
选项 | A | B | C | D |
实验目的 | 鉴别硬水 | 鉴别硫酸铵和氯化钠 | 除去二氧化碳中少量的水蒸气 | 除去氯化铜溶液中的少量盐酸 |
方案 | 加肥皂水 | 加熟石灰粉末研磨 | 通过固体氢氧化钠 | 加过量的氧化铜粉末,过滤 |

已知:铜离子是重金属离子,且步骤Ⅰ无蓝色沉淀生成.
-
(1) 步骤Ⅱ和步骤Ⅲ都需进行的操作是
-
(2) 步骤Ⅱ得到金属铜的反应的化学方程式为
-
(3) 加入少量Ca(OH)2可以降低铁屑的消耗量,原因是
-
(4) 步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有
| 选项 | 事实 | 解释 |
| A | 6000L氧气在加压情况下可装人容积为40L的钢瓶中 | 加压时氧气分子间间隔变小 |
| B | 盐酸、稀硫酸的化学性质相似 | 盐酸、稀硫酸中都含有氢离子 |
| C | 金刚石和石墨的物理性质存在着明显差异 | 它们的碳原子排列方式不同 |
| D | H2是清洁高能的燃料 | H2燃烧生成H2O没有污染 |
-
(1) 不同的碱具有相似的化学性质,原因是。
-
(2) 同学们发现,用石灰浆粉刷墙壁,一段时间后墙面就变硬了,请用化学方程式解解释这一现象;
-
(3) 依据如图可知NaOH必须密封保存,否则在空气中要变质,如果要除去在空气中已变质氢氧化钠溶液中的杂质,应选择适量的下列物质;
A.稀HCl B.硫酸 C.CaCl2 D.Ca(OH)2
以上混合物静置后再通过(操作名称),即可达到实验目的,写出除杂的化学方程式。
-
(4) 现有:HCl溶液Ba( NO3)2溶液、Na2CO3溶液、CuSO4溶液,写出一个能与NaOH溶液反应的化学方程式,反应类型为。

-
(1) 小明所在的化学兴趣小组需配制溶质质量分数为6%的氯化钠溶液80g以备实验
①需要氯化钠的质量为 g;
②配制该溶液时所需要的玻璃仪器有烧杯、玻璃棒、胶头滴管和;
③经检测配制的溶液的溶质质量分数偏大,可能的原因是(填字母序号)
A称量时,砝码端忘记垫质量相同的纸片
B取水时,俯视读数
C装瓶时,有少量溶液洒出
-
(2) 装瓶后,小明忘记及时贴上标签,以致和一瓶脱落标签的稀盐酸溶液混淆了。为了区分开来,请你帮助他完成相关实验设计:
化学方法:在不选用酸碱指示剂、pH试纸的情况下,选择合适的试剂进行鉴别。
所选试剂
。
实验操作
分别取少量试液于试管中,滴加所选试剂,观察现象
实验现象及结论
。

 和
和 结合生成BaSO4沉淀的过程
B . 向A点对应溶液中滴入紫色石蕊试液,溶液变为红色
C . 向B点的溶液中加AgNO3溶液,若生成白色沉淀,则表明加入氯化钡溶液已过量
D . 通过计算,可得A点时对应X的数值为208
结合生成BaSO4沉淀的过程
B . 向A点对应溶液中滴入紫色石蕊试液,溶液变为红色
C . 向B点的溶液中加AgNO3溶液,若生成白色沉淀,则表明加入氯化钡溶液已过量
D . 通过计算,可得A点时对应X的数值为208



