混合物的分离方法 知识点题库
结合图示实验装置,回答下列问题.

-
(1) 写出图中标号仪器的名称:a;
-
(2) 实验室选用D装置制取氧气,其反应的化学方程式为,
二氧化锰是该反应的,为了从反应后的剩余物中回收二氧化锰,实验操作为溶解、、洗涤干燥.
-
(3) 实验室制取氢气时,选用B装置为发生装置的优点是,选择的收集装置是(填序号).
-
(4)
某同学用G装置收集二氧化碳,验满的方法是;若用C装置制取二氧化碳,打开如图装置中分液漏斗的活塞后,水不能滴下,该同学认为整套装置不漏气,你认为他的判断(填“正确”或“不正确”);实验室为了除去其中的氯化氢气体,并将剩余气体收集在集气瓶中,下列装置中最为合理的是装置(填序号),左边试剂瓶中盛放的试剂是.
如图所示为实验室中常见的气体制备、干燥、净化和收集实验的部分仪器,试根据题目要求,回答下列问题: 
-
(1) 若用Zn和稀硫酸反应制取并收集干燥的氢气.
①所选仪器的连接顺序为:.
②生成氢气时,发生反应的化学方程式为.
③经测定,装置A中锌粒和稀硫酸反应后溶液的pH7(填“变大”“变小”“不变”之一).
-
(2) 若以H2O2溶液为原料(MnO2为催化剂)在实验室中制备干燥的氧气,并用来测定,CuO和Cu的混合物样品中CuO的质量分数,仪器的连接顺序为,A→B1→C→B2 , (B1、B2为浓硫酸洗气瓶),并检验装置的气密性,所设计的实验装置中气体流向是从左向右,小明同学取了氧化铜和铜的混合物样品ag,进行实验:
①根据完全反应后的C装置的质量变化测定CuO的质量分数,若测得C处大玻璃管内的物质总质量增加bg,则混合物样品中CuO的质量分数(计算结果可为a和b表示的代数式)
②若C处大玻璃管中红色的固体还没有完全消失就测定,则样品CuO的质量分数的测算结果将(填“偏大”“偏小”“不受影响”之一).
③二氧化锰是H2O2溶液制氧气反应的 ,反应后的二氧化锰还可以进行回收重复利用,可采用的操作方法是 ,洗涤,干燥.
工厂排放的废水中含有硫酸铜、硫酸亚铁和硫酸锌.同学们想从废水中回收硫酸锌和金属铜.设计了如下实验过程:
请回答下列问题:
-
(1) 操作一的名称为,操作二的名称为.
-
(2) 固体A中含有的物质是,溶液B中的溶质是.
-
(3) 所加试剂E的名称为.
-
(4) 加试剂E发生反应的化学方程式为.
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙.但其中是否含有氯化氢需要通过实验来证明.若剩余溶液显酸性(含有H+),说明含有氯化氢.
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性.
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温.
实验操作 | 实验现象 | 实验结论 | |
甲同学 | 取烧杯中溶液少许于试管中,向其中滴加 | 现象:溶液变为红色 | 溶液显酸性(含有H+);溶质中有氯化氢. |
乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象: 反应的化学方程式是: | |
丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量石灰石 | 现象: |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的(填化学式),经、蒸发等操作后即可完成.
-
(1) 用如图1所示装置进行实验,探究物质溶解是吸热还是放热,仪器a的名称是.若出现导管中红墨水液面左管降低右管升高,则试管中加入的物质可以是(填序号).
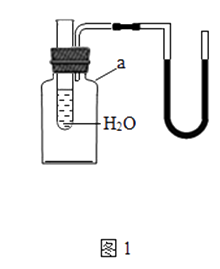
A.NH4NO3固体;B.浓硫酸;C.NaOH固体;D.CaCO3固体.
-
(2) 实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式是,反应中二氧化锰的作用是.要从充分反应后的剩余固体中分离出氯化钾晶体,需要进行的实验操作有.
-
(3) 某化学学习小组的同学在网上查资料时得知,金属钠着火不能用CO2灭火.他们想知道,Na与CO2反应究寓会生成什么物质呢?
【提出猜想】
Ⅰ.4Na+CO2
 2Na2O+C
2Na2O+CⅡ.4Na+3CO2
 2Na2CO3+C
2Na2CO3+CIII.2Na+2CO2
 Na2O+2CO
Na2O+2CO溶液检验:PdCl2+CO+H2O═Pd(黑色)↓+2HCl+CO2
【实验操究】该小组成员设计了如图2所示实验:

【分析讨论】
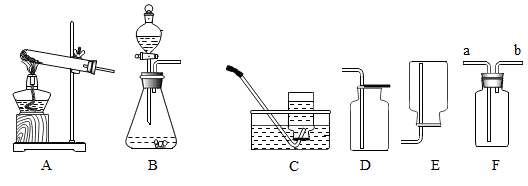
①装置A用盐酸与石灰石反应制备CO2 , 反应的化学方程式为.为使制备CO2的反应能随开随用,随关随停,所选装置应是图3中的.

②装置B的作用是除去二氧化碳气体中混有的HCl气体,反应的化学方程式是;装置C的作用是.
③经检查整套装置气密性良好,装好药品使A中产生CO2 , 必须待装置E中出现现象时再点燃酒精灯,其目的是.
【实验结论】
实验观察到的现象是:装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,则猜想是正确的.
-
(1) 将固体混合物放入烧怀中,加入足量的水搅拌,然后将其过滤,过滤时玻璃棒的作用是.
-
(2) 过滤后的滤液仍然浑浊的原因是,.
-
(3) 蒸发滤液,当蒸发皿中出现时停止加热.
-
(4) 在进行过滤操作时,除了使用铁架台、烧杯、玻璃棒以外,还需要的仪器是A . 酒精灯 B . 托盘天平 C . 蒸发皿 D . 漏斗.
-
(5) 分离混合物常用的方法有:A、过滤B、蒸发C、蒸馏.选择合理的方法分离下列混合物(填序号).
①食盐和泥沙②酒精和水③海水中获取食盐
①烧瓶 ②烧杯 ③蒸发皿 ④玻璃棒 ⑤集气瓶 ⑥漏斗 ⑦燃烧匙 ⑧酒精灯.
| 序号 | 混合物(括号内为杂质) | 除去杂质的方法 |
| A. | 铜粉(铁粉) | 加入过量稀盐酸,过滤、洗涤、干燥 |
| B. | 硫酸(盐酸) | 适量的硝酸银溶液,过滤 |
| C. | 二氧化碳(一氧化碳)) | 灼热的铜 |
| D. | 二氧化锰(氯化钾) | 溶解,过滤,蒸发 |
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别木炭粉和氧化铜粉末 | 取样,加稀硫酸 |
| B | 除去MnO2中少量的KMnO4 | 加热固体混合物 |
| C | 检验氧气是否收集满 | 将带火星的木条伸入集气瓶内 |
| D | 分离CaCl2和CaCO3的固体混合物 | 加足量水溶解,蒸发 |
-
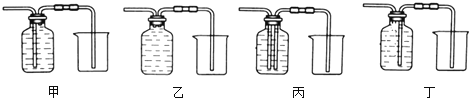
(1) 装置C、D、E、F在实验室中都可收集气体,其中不能用来收集氧气的是(填字母编号)。若用F装置收集二氧化碳,气体应从(填“a”或“b”)端通入。
-
(2) 英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为,1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为色。
-
(3) 将产生的氧气通入如图烧杯中,可观察到白磷燃烧起来,说明白磷燃烧需要的条件是。

-
(4) 加热氯酸钾和二氧化锰的固体混合物制取氧气,充分反应后,利用下列流程回收反应后的固体。
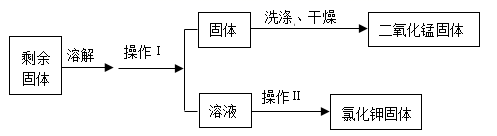
①加热氯酸钾和二氧化锰的混合物制取氧气的化学方程式为。
②操作Ⅰ的名称是,操作Ⅰ和操作Ⅱ都用到的玻璃仪器是。



