物质的量及相关计算 知识点题库
-
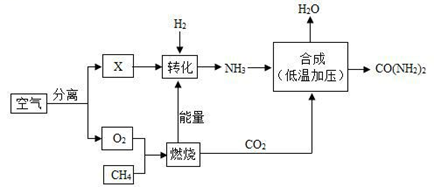
(1) 空气属于(填“纯净物”或“混合物”),X 是空气中含量最多的气体,其化学式为。图中分离空气的过程属于变化(填“物理”或“化学”)。
-
(2) 空气中含有的少量稀有气体的化学性质(填“活泼”或“稳定”)。工业上用煅烧石灰石制取二氧化碳的化学反应方程式为;反应类型为反应(填“化合”或“分解”)。
-
(3) 天然气的主要成分是CH4 , 天然气属于再生资源(填“可”或“不可”)。点燃CH4之前应。甲烷完全燃烧的化学反应方程式为。由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有变化(填“能量”或“原子个数”)。
-
(4) 尿素是一种优质氮肥化学式(CO(NH2)2),尿素的摩尔质量为;1mol尿素分子中含有mol原子,CO(NH2)2中碳、氧、氮、氢原子的个数比为,0.1mol尿素含有个尿素分子。

①仪器名称:a 为。
②装置 B 制取氧气的化学方程式为,可选择的收集装置为(填装置编号)。
③可用来制取二氧化碳的发生装置共有(填装置编号)。
④F 中是否在发生反应(填“是”或“否”),关闭活塞 K 后的现象为。
⑤用如图装置收集二氧化碳,应从口进入(填“a”或“b”),植物油的作用是。

⑥用含碳酸钙 10g 的大理石(杂质与酸不反应)和足量稀盐酸反应,计算制得二氧化碳的物质的量为多少?(根据化学方程式列式计算)
要求:写出计算过程,结果保留一位小数


-
(1) 以上微观示意图中发生的是化合反应,请在方框中补画相应微粒的图示。
-
(2) 该反应中属于氧化物的是(选填甲、乙、丙)。
-
(3) 该反应中参与反应的甲和丙的物质的量之比为,该反应中化合价升高的元素是。


-
(1) 图中仪器a的名称是。
-
(2) 实验室用氯酸钾和二氧化锰混合制取O2 , 反应的化学方程式为;
其中二氧化锰固体的颜色是。
-
(3) 实验室用大理石和稀盐酸制取一瓶CO2 , 发生装置选择(填“A”或“B”);
用D装置收集二氧化碳,检验集满的方法是。
-
(4) 实验室用稀硫酸和锌粒反应制取氢气,可选择C作为发生装置,理由是;
E装置可用来测量生成氢气的体积,进行操作时,集气瓶未装满水是否会影响实验结果(填“是”或“否”)。
-
(5) 计算制取0.5 mol氢气至少需要多少克锌粒与稀硫酸反应?。
(根据化学方程式列式计算)
-
(1) 自来水厂净水过程中除去色素和异味用到,其作用是吸附作用;
-
(2) 家用天然气的主要成分是甲烷,写出甲烷燃烧的化学方程式;
-
(3) 炒菜时,不小心将食盐洒落在火焰上,会发出颜色。
-
(4) 为预防新型冠状病毒,复课后学校每天会在教室喷撒二氧化氯(ClO2)溶液等消毒液,喷洒后,室内充满消毒液气味,这说明(从微观角度分析),ClO2由种元素组成,其中Cl元素的化合价为,1mol ClO2中约含个Cl原子。

请按要求填空:
-
(1) 将部分消毒剂中的主要成分进行分类(选填“有机物、酸、碱、盐、氧化物”)
物质
酒精
次氯酸钠(NaClO)
过氧化氢
物质类别
-
(2) 使用医用酒精进行消毒时,要远离明火,这是因为酒精具有的化学性质。
-
(3) 公共场合可用0.5%的过氧乙酸(化学式为C2H4O3)溶液进行消毒。过氧乙酸的摩尔质量为,1摩尔过氧乙酸中碳原子的个数为个(用科学记数法)。若要配制这样的溶液1000克,需要过氧乙酸克。
①下列对酒精性质的描述,属于化学性质的是。(填写编号)
A易挥发 B消毒杀菌 C无色有特殊香味 D熔点-114℃、沸点 78℃
②在酒精分子中,C、H、O 的原子个数比为;酒精的摩尔质量为;0.5mol 酒精含有个氧原子。
③“84 消毒液”与厕所清洁剂(俗称“洁厕灵”,有效成分为稀盐酸)可发生反应:NaClO+2HCl=NaCl+Cl2↑(有毒)+H2O,在使用过程中,这两种物质(填“能”或“不能”)混合使用。

按图示连接装置并加入药品,取用的泡腾片质量为4 g。打开止水夹a通入适量空气后,称量D装置,其质量为m1 g。关闭止水夹a,用注射器向B装置中注入适量水。待装置B中无气泡产生后,打开止水夹a,再次通入适量空气,第二次称量D装置,其质量为m2 g。
回答下列问题:
-
(1) A装置中浓NaOH溶液的作用是,B装置盛装泡腾片的仪器名称是。
-
(2) C装置中浓硫酸的作用是。
-
(3) 碱石灰主要含CaO和NaOH,D装置中碱石灰吸收CO2质量增加,写出所涉及反应的一个化学方程式:。
-
(4) 步骤中再次通入空气的目的是。
-
(5) 实验测定泡腾片中所含NaHCO3的质量分数为(用含m1、m2的代数式表示)。若省略E装置,则测得NaHCO3的质量分数(填“偏大”“偏小”或“不变”)。

-
(1) 上图是某矿泉水标签的部分内容,根据标签回答下列问题:
Ⅰ、该矿泉水是(选填“纯净物”或“混合物”);
Ⅱ、H2SiO3中Si的化合价为;
Ⅲ、由标签可知该矿泉水中含有种金属元素;该矿泉水呈(选填“酸性”、“碱性”或“中性”)。
-
(2) 布洛芬为常见的解热镇痛类药物,具有镇痛、抗炎作用;通过下丘脑体温调节中枢而起解热作用,其化学式为C13H18O2.现有2mol的C13H18O2 , 请问其氢氧原子的原子个数比为,氢元素的质量为g,碳原子的物质的量为。

-
(1) 碳酸钠溶液的溶质是,溶剂是。
-
(2) 乙酸是一种常见的有机酸,化学式为C2H4O2 , 乙酸的摩尔质量为,0.5 mol乙酸中约含有个碳原子,含有g氢元素。
-
(3) 为使五环变色,分别向1号环和3号环中滴加几滴紫色石蕊溶液并混合均匀,分别观察到1号环由无色变为蓝色,3号环由无色变为,向4号环中滴加几滴甲基橙溶液并混合均匀,观察到4号环由无色变为黄色,说明甲基橙溶液遇(选填“酸性”、“碱性”或“中性”)溶液变黄色。向5号环滴加几滴紫色石蕊和甲基橙并混合均匀后,观察到溶液由无色变绿色。
-
(4) 向2号环中先滴加几滴淀粉溶液,再滴加几滴稀硫酸,发生以下反应,生成的碘遇淀粉变深蓝色。请补全以下化学方程式。5KI+KIO3+3H2SO4=3K2SO4+3I2+3
实验编号 | 金属丝(直径1 mm) | 溶液 |
A | 0.056g铁丝 | 5mL5%稀盐酸 |
B | 0.056g铜丝 | 5mL5%稀盐酸 |
C | 0.056g银丝 | 5mL5%稀盐酸 |
D | 0.056g铁丝 | 5mL5%硫酸铜溶液 |
E |
-
(1) 铁、铜、银中金属活动性最强的是,A组反应的化学方程式是。
-
(2) D组反应的现象是,请补全E组实验试剂 。
-
(3) 实验结束后,发现D组中0.056g铁丝已完全反应,求消耗多少mol硫酸铜?(请根据化学方程式列式计算)
-
(4) 回收未完全反应的金属丝,收集A、B、C、D组实验的废液,放置一段时间后得到含盐酸、氯化铁、硫酸铁和硫酸铜的混合溶液,向其中逐滴滴加氢氧化钠溶液,直至溶液变为中性,此时溶液中的溶质是 (硫酸铁、氯化铁、硫酸铜溶液均显酸性)。



