物质的量及相关计算 知识点题库
①O3能吸收紫外线。与O3互为同素异形体的物质化学式是。
②SO2是一种大气污染物。SO2中S元素化合价是,S、O原子个数比是;SO2的摩尔质量为g/mol;1mol SO2中约含个S原子。
③大气中的CO2使地球保持温暖。将过多CO2转化为甲醇(CH3OH)等燃料的过程属于(选填“物理”、“化学”)变化;CH3OH由种元素组成。
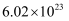 个微粒
C . 物质的量就是物质的质量
D . 物质的量表示一定量数目的微粒的集合体
个微粒
C . 物质的量就是物质的质量
D . 物质的量表示一定量数目的微粒的集合体
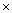 1023个氧分子
B . 1molH2O中含有2mol氢和1mol氧
C . 等物质的量的CO2比CO多一个氧原子
D . 等质量的O2和O3 , 它们的物质的量之比为3:2
1023个氧分子
B . 1molH2O中含有2mol氢和1mol氧
C . 等物质的量的CO2比CO多一个氧原子
D . 等质量的O2和O3 , 它们的物质的量之比为3:2
-
(1) I.用化学认识生活
①写出符合要求的物质化学式:
自然界中最硬的物质是,空气中最稳定的气体是。
②生活中某化学反应的微观过程如图,其中“
 ”和“
”和“  ”表示两种不同原子。
”表示两种不同原子。
该反应属于反应(填基本反应类型)。虚线框内应填的微观图示是(选填编号),推断的依据是。

-
(2) II.用化学解释生活
①日常生活中人们常把煤做成蜂窝状(如下图),这样做的目的是。

②共享单车轮胎材料含甲苯二异氰酸酯,化学式为C9H6N2O2 , 它由种元素组成,摩尔质量为,87g甲苯二异氰酸酯的物质的量是mol,1mol甲苯二异氰酸酯分子约含个氧原子。
-
(3) III.用化学服务生活
①碳酸饮料中,二氧化碳与水反应的化学方程式是。
②洪涝地区的灾民将河水转化为可饮用水,以下处理顺序合理的是。
①化学沉降(用明矾) ②消毒杀菌 ③自然沉降 ④加热煮沸
A.③②①④
B.③①②④
C.③①④②
D.①③④②

①氦气;3个氧分子;  ;
;  。
。
②导致酸雨的气体是;导致温室效应的气体。
③活性炭去除冰箱中的异味,是利用了它的性。
④碘酒中的溶剂是(填名称)。
⑤生石灰可以作“旺旺雪饼”干燥剂,其原理用化学方程式表示。
⑥清凉油能活血消肿、镇痛止痒,其主要成分为薄荷脑(C10H1OO)。它有种元素组成,其摩尔质量是;碳、氢元素的质量比;氧元素所占的质量分数是(精确到0.01%);73g薄荷脑的物质的量是mol,1mol薄荷脑分子约含个氢原子。
①自来水生产中消毒用到的氯气,其化学式是,物质分类中氯气属于(选填“单质”“化合物”)。
②双氧水可作伤口消毒,写出双氧水遇二氧化锰分解的化学方程式。
③新型消毒剂ClO2 , 其中氯元素的化合价是。
④酒精(C2H5OH)是由种元素组成,其中元素质量分数最高的元素是,1mol酒精所含氧原子的数目约为(科学记数法表达)。
-
(1) 活性炭口罩能较好阻隔有害气体,主要是利用了活性炭的性。
-
(2) 免洗洗手液能有效杀菌,某免洗洗手液的主要有效成分为乙醇(化学式为C2H6O),乙醇由种元素组成,乙醇的摩尔质量为,乙醇中碳、氢、氧三种元素的原子个数比为,0.5mol乙醇中约含个碳原子。
-
(1) “侯氏制碱法”生产出Na2CO3的同时得到副产品NH4Cl,生产原理如下图。

Ⅰ、Na2CO3的类别属于(选填“酸”、“碱”或“盐”);副产品NH4Cl可作(选填“氮”、“磷”或“钾”)肥。
Ⅱ、制纯碱的过程中,可以循环利用的物质是。
-
(2) 下图是氯化钠、碳酸氢钠、氯化铵的溶解度曲线(资料:60℃时溶液中的碳酸氢铵受热分解)

Ⅰ、0℃时,碳酸氢钠的溶解度是。
Ⅱ、20℃时,将20g氯化钠加入50g水中,充分溶解后得到(填“饱和”或“不饱和”)溶液。
Ⅲ、产物中NaHCO3比NH4Cl先结晶析出。结合①中生产原理及溶解度曲线解释其原因。
-
(3) “侯氏制碱法”生产的纯碱中含有氯化钠。为测定纯碱样品(Na2CO3和NaCl的混合物)中碳酸钠的质量分数,兴趣小组进行了下图的实验。(过滤后滤渣损失忽略不计)

Ⅰ、纯碱样品中碳酸钠的物质的量为。
Ⅱ、实验中个别同学过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该纯碱样品中碳酸钠的质量分数(选填“偏大”、“不变”或“偏小”)。
下表是氯化钠和硫酸钠的溶解度(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.5 |
-
(1) 20℃时,用3.6克氯化钠配制氯化钠饱和溶液,需克水。一定温度下的氯化钠饱和溶液是指该条件下不能再溶解的溶液。
-
(2) 海水晒盐。某海水中主要物质的含量见表,用下列方法得到氯化钠(微量杂质忽略不计)。
物质
每100g海水所含质量(g)
水
96.5
氯化钠
2.7
硫酸钠
0.7
……
……

I.把100克该海水晒干,得到盐是。(选填“纯净物”或“混合物”)
II.写出加入X溶液发生反应的化学方程式X的物质的 量是摩尔(填选项),恰好将硫酸钠除尽。
A.0.7/208 B.0.7/142 C.2.7/58.5 D.2.7/261
III.20℃时,用13.6克的饱和氯化钠溶液充分冲洗精盐,过滤,得到滤液C的质量至少是克。检验滤渣D是否是纯净氯化钠的方法是。



