验证质量守恒定律 知识点题库
 验证质量守恒定律
B .
验证质量守恒定律
B .  测定空气中的氧气含量
C .
测定空气中的氧气含量
C .  证明CO2密度比空气大
D .
证明CO2密度比空气大
D .  证明CO2与水反应
证明CO2与水反应

-
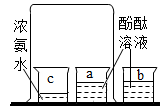
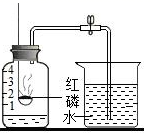
(1) 装置A 中,对比现象①②说明物质燃烧需要;对比现象①③说明燃烧需要.
-
(2) 图B是二氧化碳的性质试验,将有收集满二氧化碳气体的塑料瓶内加入少量水后立即旋紧瓶塞时观察到的现象为,其原因是,化学方程式为.
-
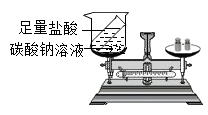
(3) 如图 C所示实验探究化学反应前后物质的质量关系.如果a、b分别是铁钉和硫酸铜溶液反应,已知:Fe+CuSO4═FeSO4+Cu,此实验中反应前的质量(填“大于”,“小于”,“等于”)反应后的质量.
|
加入稀盐酸的质量/g |
0 |
200 |
|
烧杯中物质的质量/g |
25 |
216.2 |
-
(1) 反应生成二氧化碳的质量;
-
(2) 此稀盐酸中溶质的质量分数。

-
(1) 图1为托盘天平,使用托盘天平称物品的正确操作顺序为_____。
①调游码 ②放称量纸 ③称量物放左盘
④调零点 ⑤加质量大的砝码 ⑥加质量小的砝码
A . ①②③④⑤⑥ B . ④②③⑤⑥① C . ④⑤⑥①②③ D . ④①②③⑤⑥ -
(2) 在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1 , 发生反应的实验现象为,发生反应的化学方程式为,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2 , 则(填“=”“>”“<”,)m1m2。
-
(3) 如图2装置中,称量小烧杯中所有物质的质量m1 , 然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2 , 则(填“=”“>”“<”,1分)m1m2 , 其原因为。

-
(1) 下列有关图一实验说法错误的是_____A . 甲、乙实验都可以用来验证分子在不断运动 B . 浓氨水的挥发性属于化学性质 C . 该实验的不足之处是会造成大气污染 D . 乙中B溶液比甲中先变红,证明分子运动速率与温度有关
-
(2) 写出丙中反应的化学方程式;写出戊中反应的化学方程式;
-
(3) 下列关于实验二的说法正确的是_____A . 丙和丁装置均可验证质量守恒定律 B . 丙中气球可以调节瓶内压强 C . 戊实验说明水中含有氢分子和氧分子 D . 戊中a管中的气体能使带火星木条复燃

-
(1) 甲为蒸发溶液的实验。加热时若不搅拌,造成的后果是;当观察到时,停止加热。
-
(2) 乙为通过红磷燃烧前后质量的测定验证质量守恒定律的实验。用红热的玻璃管引燃红磷,实验现象是:红磷燃烧,产生,放出大量热。
实验中气球的作用除了使装置密闭之外,还可以防止;实验时若取用红磷的量不足,对实验的结果 (选填“有”或“没有”)影响。
 验证质量守恒定律
B .
验证质量守恒定律
B .  证明二氧化碳密度比空气大
C .
证明二氧化碳密度比空气大
C .  氧气验满
D .
氧气验满
D .  探究分子运动
探究分子运动
| A | B | C | D | |
| 方案 | | | | |
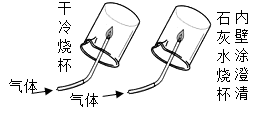
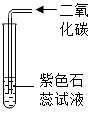
| 现象 | a中酚酞溶液变红,b中酚酞溶液不变红 | 点燃某气体后, 干冷烧杯内壁出现无色液滴,澄清石灰水变浑浊 | 紫色石蕊溶液在通入二氧化碳后变红 | 反应后天平失去平衡 |
| 结论 | 分子在不断运动 | 该气体中一定有碳元素、氢元素和氧元素 | 使石蕊溶液变红的是二氧化碳 | 该反应不遵循质量守恒定律 |

-
(1) 用实验一所示装置探究化学反应前后物质的总质量是否发生改变,反应前托盘天平的指针指向刻度盘的中间,则容器内的两种物质反应后,托盘天平的指针(选填“向左”、“向右”、“不”)偏转,原因是。
-
(2) 实验二中,将完全相同的两只纸船分别放在薄铜片的两侧,向其中一只加入一半水,加热铜片的中部,观察到不装水的纸船很快燃烧,装水的纸船不燃烧,通过此实验,可说明燃烧的条件之一是。
-
(3) 对比实验三中木炭在空气中和在氧气中燃烧的实验现象,说明可燃物燃烧的剧烈程度与有关。


-
(1) 装置:锥形瓶的底部铺有一层细沙,其作用是。
-
(2) 燃烧前称量,锥形瓶的总为 28.6g,则图中托盘天平中游码的读数为。
-
(3) 白磷燃烧:白磷燃烧过程中看到的现象是。
-
(4) 燃烧后称量:发现托盘天平指针偏向右边,造成的原因可能是。
-
(5) 反思:白磷燃烧(填“遵守”或“不遵守”)质量守恒定律
-
(1) 若由分离空气来提供所需氧气,则需空气体积多少m3 ?
-
(2) 若加热高锰酸钾来提供所需氧气,至少需要高锰酸钾多少千克?
-
(1) 验证质量守恒定律的装置如图所示。

I先将锥形瓶(包括玻璃管、橡胶塞、药品、气球等)放在托盘天平上称量。
II把橡胶塞的玻璃管放到酒精灯火焰上灼烧至红热,迅速用橡胶塞将锥形瓶塞紧,观察现象。
①实验中,锥形瓶里发生反应的化学方程式为。
②气球的作用是。
③反应后,待锥形瓶冷却,再次放到托盘天平上称量,托盘天平仍然平衡,请从微观角度解释红磷燃烧前后天平平衡的原因。
-
(2) 小明和小红同学分别取一根用砂纸打磨干净的长镁条和石棉网,将其放在托盘天平上称量,记录所称质量(第一次称量)。在石棉网上方点燃镁条,待镁条燃烧后,将其产物与石棉网一起称量(第二次称量)。
①镁条燃烧的现象是。
②小明和小红同学的第二次称量结果不同。
A小明同学的第二次称量质量减轻,原因是。
B小红同学的第二次称量质量增大,原因是。

(提出问题)物质发生化学变化前后总质量真的不变吗?
(实验与讨论)如上图实验
-
(1) 若甲组实验燃烧前后称量的总质量均为27.6g,则托盘天平中游码的读数为g。如果发现托盘天平指针偏向右边,造成的原因可能是(写一条即可)。
-
(2) 乙组实验药品混合前、后称量的质量关系为m前>m后 , 原因是;若该实验试剂不变,则此装置的改进方法是。
-
(3) 丙组实验药品混合前、后称量的质量关系为m前=m后 , 乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,原因是。
-
(4) 丁组实验的化学反应方程式是。铁钉与硫酸铜溶液反应前后各物质的质量总和(填“有”或“无”)变化。
(实验结论)物质发生化学变化前后总质量真的不变。
-
(5) (实验拓展)若把甲中的红磷换成白磷如图A做实验,结果物质质量反应前后守恒,A中白磷有剩余。为了防止白磷自燃,将锥形瓶瓶口倒置于盛有热水的水槽中如图B,瓶口紧贴水面,拔下瓶塞,发现水进入锥形瓶中,约占锥形瓶容积的,剩余白磷不能燃烧,原因是。

-
(1) A实验中集气瓶中水的作用是;
-
(2) B实验的名称是;
-
(3) C实验过程中,当蒸发皿中出现时,停止加热。玻璃棒的作用是。
 B . 探究水的组成
B . 探究水的组成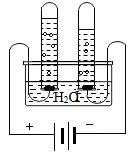 C . 验证质量守恒定律
C . 验证质量守恒定律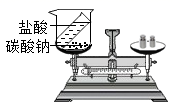 D . 比较二氧化碳的含量
D . 比较二氧化碳的含量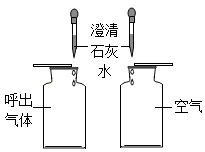
 验证质量守恒定律
B .
验证质量守恒定律
B .  比较合金和纯金属的硬度
C .
比较合金和纯金属的硬度
C .  探究分子运动
D .
探究分子运动
D .  探究燃烧条件
探究燃烧条件
-
(1) 验证质量守恒定律。
步骤1:在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为m1。
步骤2:将铁钉浸入到CuSO4溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有CuSO4溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为m2
①用砂纸将铁钉打磨干净的作用是。
②步骤2中可观察到明显的实验现象是。该变化可说明Fe和Cu的金属活动性由强到弱的顺序是。
③若m1=m2 , 可证明参加反应的Fe和CuSO4的质量总和等于。
-
(2) 探究CuSO4溶液对H2O2分解具有催化作用。
①若要证明CuSO4溶液对H2O2分解具有催化作用,除需证明CuSO4在反应前后化学性质和质量不发生改变外,还需证明的是。
②为探究CuSO4在反应前后质量是否发生改变,某同学设计如下实验:
向H2O2溶液中滴入10ga%的CuSO4溶液,待反应完全后,向试管中加入足量的BaCl2溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为bg。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物bg计算出溶液中CuSO4的质量0.1ag。(填“大于”或“小于”或“等于”)
-
(3) 将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。

①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为。
②1000℃时,CuO开始发生分解反应,生成Cu2O和O2.计算图中m的值。(写出计算过程)
 B . 量取9.5mL液体
B . 量取9.5mL液体 C . 验证质量守恒定律
C . 验证质量守恒定律 D . 加热液体
D . 加热液体