质量守恒定律及其应用 知识点题库

-
(1) 图中瓶底铺细沙的作用是:.
-
(2) 白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论是质量不守恒.待锥形瓶冷却后,重新放到托盘天平上称量,天平保持平衡.结论是:质量守恒.你认为结论正确的是( 填“前一种”或“后一种”).而导致另一种结论错误的原因是.
-
(3) 实验观察到A、C中气球的大小不同,用理化知识解释产生此现象的原因是:.
-
(4) 由质量守恒定律可知,化学反应前后,一定不变的是.(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.
-
(1)
“侯氏制碱法”的两步主要反应原理可表示为:
①NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,
②2NaHCO3
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.其中,NaHCO3属于(“酸”、“碱”或“盐”).反应②属于(填一种基本反应类型)反应,该反应(选填“吸收”或“放出”)热量.
-
(2) 在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的N2和CO2 , 从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B═3N2↑+5CO2↑+19H2O,其中B物质的化学式是.
-
(3) 有些工厂排放的废水中含有硫酸,如果用氨水(NH3•H2O)中和它,能得到一种铵态氮肥,该反应的化学方程式为:.
 钠的氧化物
钠的氧化物  氢氧化钠溶液
氢氧化钠溶液 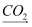 白色固体
白色固体 【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
-
(1) 【作出猜想】常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2CO3 ,
猜想3:
-
(2) 【实验探究一】
实验操作
实验现象
实验结论
取少量钠的氧化物加入足量蒸馏水
②
猜想1正确
-
(3) 【继续探究】钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】
实验操作
实验现象
实验结论
取少量白色固体加入足量
③
产生白色沉淀
白色固体成分为Na2CO3
和NaOH
过滤、取少量滤液加入④
⑤
-
(4) 【实验反思】
①类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式.
②过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为
③能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2⑧碱性氧化物(填“是”或“不是”).
 mCO2+nH2O中,各化学式的计量数之间的关系正确的是( )
mCO2+nH2O中,各化学式的计量数之间的关系正确的是( )

-
(1) 仪器⑥的名称是;从图1中选择实验室制备并收集二氧化碳的仪器组合(填序号),该装置还可用于实验室制氧气,写出相关的制氧气的化学方程式.
-
(2) 氯气是一种重要的化工原料,它是一种黄绿色的有毒气体,密度比空气大,能溶于水,并能与氢氧化钠等碱溶液反应.

①实验室制取氯气的反应原理为MnO2(固体)+4HCl
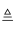 X+2H2O+Cl2↑,则X的化学式为.
X+2H2O+Cl2↑,则X的化学式为.②实验室用图2装置可制取并收集一瓶纯净干燥的氯气,导管接口的正确连接顺序是a→(填字母),其中包含食盐水作用是.

-
(1) 完全反应时,生成氧气的质量为。
-
(2) 完全反应后,剩余固体物质属 (填纯净物、混合物)。
-
(3) 原固体混合物中氯酸钾的质量为 (列式计算)。
 加热高锰酸钾制氧气,生成二氧化锰质量的变化
B .
加热高锰酸钾制氧气,生成二氧化锰质量的变化
B .  加热一定质量的高锰酸钾固体
C .
加热一定质量的高锰酸钾固体
C .  用两份等质量、等浓度的过氧化氢溶液分别制取氧气,生成气体质量的变化
D .
用两份等质量、等浓度的过氧化氢溶液分别制取氧气,生成气体质量的变化
D .  等质量的锌粉和铁粉分别与足量的等浓度的稀盐酸反应,生成气体质量的变化
等质量的锌粉和铁粉分别与足量的等浓度的稀盐酸反应,生成气体质量的变化
-
(1) 推断X的化学式是;
-
(2) 此反应的基本类型属于;
-
(3) 浓硝酸需要保存。
| 物质 | a | b | c | d |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | 待测 | 26 | 2 | 12 |
|
反应前 |
反应后 |
||
|
实验数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
|
150g |
12g |
157.6g |
-
(1) 反应中生成二氧化碳的质量为多少?
-
(2) 求该石灰石中碳酸钙的质量分数.
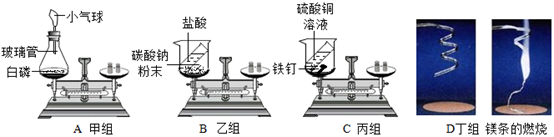
A、B、C、D四个实验分别由甲、乙、丙、丁四个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
-
(1) A实验:实验现象是。白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡。结论是:质量不守恒。待锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。你认为结论正确的是 (填“前一种”或“后一种”),而导致另一种结论错误的原因是。
-
(2) 丙组同学认为C实验说明了质量守恒。请你从原子的角度解释原因:。
-
(3) 乙、丁两组同学得到的不正确结论是“实验B、D均说明质量不守恒”。老师引导同学们分析了B、D两个实验反应前后天平不平衡的原因。你认为B实验天平不平衡的原因是;D实验的反应方程式是,属于反应。(填基本反应类型)。
-
(4) A、B、C、D所示四个实验中能用质量守恒定律解释的是实验(选填字母序号,下同),上述现象能用来验证质量守恒定律的是实验。
(提出问题)红色固体是什么物质?
(查阅资料)①硫酸铜晶体或硫酸铜溶液为蓝色;无水硫酸铜是一种白色固体;温度达到200 ℃时,CuSO4开始分解生成CuO和另一种氧化物,反应过程中元素的化合价不变;
②温度超过1 000 ℃时,CuO分解生成红色的Cu2O;Cu2O难溶于水,但能与稀硫酸发生反应,生成Cu2+和Cu。
-
(1) (猜想与假设)猜想1:红色固体是Cu;
猜想2:红色固体是Cu2O;
猜想3:红色固体是;
猜想4:红色固体是Fe2O3。
-
(2) (进行实验)将红色固体加入足量的稀硫酸中,无明显现象,说明猜想成立。
-
(3) (交流讨论)
通过讨论,同学们一致认为猜想4不成立,理由是。
-
(4) 加热时,浸有硫酸铜溶液的滤纸刚开始不燃烧,原因是。
-
(5) 实验中,CuSO4受热分解生成CuO和(填化学式)。
-
(6) 滤纸的组成元素是C、H、O,实验中产生铜的原因可能是滤纸在燃烧过程中产生的碳与分解产生的氧化铜发生了反应;同时该实验还说明滤纸的着火点低于1 000 ℃,理由是
。


 4NO+6H2O则X的化学式为( )
4NO+6H2O则X的化学式为( )
-
(1) 氢气是理想的燃料,理由是。
-
(2) 下图为氢气燃烧反应的微观示意图,在方框内补全相应微粒的图示。




