晶体和结晶的概念与现象 知识点题库
如图是甲和乙的溶解度曲线.下列说法中正确的( )

(1)t1℃时,a物质的溶解度b物质的溶解度.(填“>“、“<“或“=“)
(2)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号).
(3)t2℃时,将50克a物质溶于150克水中得到的溶液是 (填“饱和“或“不饱和“)溶液.
(4)将t2℃时等质量的a、b、c物质的饱和溶液降温到t1℃时,析出晶体最多的是 .

根据如图中A、B、C三种物质(均不含结晶水)的溶解度曲线,回答下列问题:

-
(1) t1℃时,A、B、C三种物质的溶解度由大到小的顺序是.
-
(2) t2℃时,向100水中加入20A物质,充分溶解后,所得溶液是(填“饱和”或“不饱和”)溶液.
-
(3) 将t3℃时等质量A、B的饱和溶液分别降温至t2℃,对所得溶液的叙述正确的是 (填序号).
①溶质质量:A>B ②溶剂质量:A<B ③溶质质量分数:A=B.

①可用降温结晶法提纯含少量Na2SO4的NaCl
②45℃时,使Na2SO4饱和溶液析出晶体的措施仅有加热升温、冷却降温和蒸发水3种
③20℃时,向125g溶质质量分数为20%的食盐水中加入15g NaCl粉末并振荡,会出现浑浊
④将相同质量的Na2SO4和NaCl的饱和溶液从40℃降温至10℃,前者析出晶体的质量大.

-
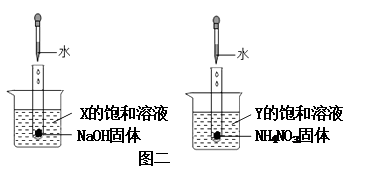
(1) X,Y两种物质的溶解度变化趋势的共同点是;
-
(2) 温度越高,X的饱和溶液中X的质量分数(填“越大”或“越小”);
-
(3) 将a1gY的饱和溶液降温结晶,析出晶体(不含结晶水)mg,得到溶液a2g,则a1 , a2 , m的关系是(填序号).
a.a1>a2+m b.a1=a2+m c.a1<a2+m d.无法确定
-
(4) 保持温度不变,X的饱和溶液和Y的饱和溶液混合(X与Y不反应)后得到的溶液是(填序号)
a.X的饱和溶液和Y的饱和溶液 b.X的不饱和溶液和Y的饱和溶液
c.X的饱和溶液和Y的不饱和溶液 d.X的不饱和溶液和Y的不饱和溶液.


-
(1) t1℃时,三种物质中溶解度最大的是.
-
(2) 溶解度随温度升高而减小的是.
-
(3) t2℃,将质量相等的甲、乙、丙三种物质的饱和溶液降温至t1℃,析出晶体最多的是.
-
(4) t2℃,将30g甲物质加入到50g水中充分搅拌,形成甲物质的(填“饱和溶液”或“不饱和溶液”)
温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 1.68 | 3.73 | 7.3 | 13.4 |

-
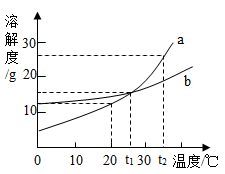
(1) P点的含义是t2℃时,a、c溶解度都为。
-
(2) t3 ℃时,50 g a放入50 g水中形成的溶液中溶质和溶剂的质量比为。若再加10g、t3℃的水,此时该溶液为(选填“饱和”或“不饱和”)溶液
-
(3) 下列说法正确的是。
①t2 ℃时,b的溶液中溶质的质量分数一定比a、c的溶液中溶质的质量分数大;
②将t3 ℃时,a、c的饱和溶液分别降温至t2 ℃,此时两溶液中溶质的质量分数相等;
③当a中混有少量b时,可用降温结晶的方法提纯a
④在t1 ℃时,把等质量的a、b、c三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为a>b>c
⑤将t3 ℃时,a、b的饱和溶液分别降温至t1℃,析出晶体的质量a>b
已知硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,熟石灰的溶解度随温度升高而减小。

-
(1) A是的溶解度曲线。
-
(2) 50℃时,硝酸钾的溶解度(大于、小于或等于)氯化钠的溶解度。
-
(3) 硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是。
-
(4) 欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是。
-
(5) 如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是(填序号)。 ①反应放热,温度升高,氢氧化钙溶解度减小 ②反应消耗水,氢氧化钙析出
③生石灰与水反应生成的氢氧化钙不再溶解。
-
(6) 20℃时氯化钠的溶解度为36g,20℃时,将20g氯化钠放入50g水中,充分溶解后,溶液中溶质的质量:溶剂质量:溶液质量=。



-
(1) 从表中数据分析,溶解度受温度影响较大的物质是,硝酸钾和氯化钠溶解度曲线的交点在(填字母序号)之间。
A 20℃~30℃ B 30 ℃~40℃ C 40℃~50℃
-
(2) 20 ℃,将50 g硝酸钾与100 g水混合,充分搅拌后静置,得到的溶液是硝酸钾的(“饱和”或“不饱和”)溶液,若将温度升高到40 ℃,该溶解溶质的质量分数为(精确到0.1%)。
-
(3) 保持温度为20 ℃,将氯化钠的不饱和溶液变成饱和溶液,写出一种可行的方法。

-
(1) P点所表示的含义是。
-
(2) t1℃时,将20g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶度质的质量分数为。
-
(3) t3℃时,将接近饱和的硝酸钾溶液变为该温度下的饱和溶液,可以采用的方法是。
-
(4) 分别将100gt3℃的硝酸钾和氯化钾的饱和溶液降温至t2℃,过滤,得到硝酸钾的溶液a和氯化钾的溶液b。对于溶液a和溶液b,下列说法错误的是(填字母)
A 溶质的质量分数a=b
B 溶液质量a<b
C 溶质质量a=b
D 溶剂质量a<b
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
NaCl溶解度(g/100g水) |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
KNO3溶解度(g/100g水) |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
①40℃时,NaCl的溶解度是。
②20℃时,将等质量KNO3和NaCl固体,分别加入到盛有100g的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。

根据图1和图2现象判断:甲烧杯中的固体是;将图2中的两溶液降温至40℃时,对两种溶液的分析正确的是。
A.甲一定是饱和溶液 B.两溶液中溶质质量分数一定相等
C.甲一定会析出晶体 D.甲溶液浓度一定大于乙溶液浓度
③如果60℃时KNO3饱和溶液中混有少量NaCl时提纯KNO3可采用方法。
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,所得溶液中溶质质量分数大的
是溶液。

-
(1) 50℃时,KNO3的溶解度是g;
-
(2) NaCl和KNO3的溶解度受温度影响较大的是(填化学式);
-
(3) 20℃时,将20gNaCl加入50g水中,充分溶解后,所得溶液的质量是g;
-
(4) 将20℃时的NaCl和KNO3饱和溶液分别升温至50℃,所得溶液溶质的质量分数大小关系是: NaClKNO3(填“>”、“=”或“<”)。



