除杂 知识点题库
下列除杂质(括号内为杂质)方法不合理的是( )
A . Fe2+(Fe3+),加过量铁粉,过滤
B . Mg(Al),加过量NaOH溶液,过滤
C . CO2(HCl),过量饱和碳酸钠溶液,洗气
D . 食盐(碘),加热,升华
下列物质的分离方法正确的是( )
①用升华法分离碘和氯化铵的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物
①用升华法分离碘和氯化铵的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物
A . ①②
B . ②③
C . ③④
D . ②④
下列说法正确的是( )
A . 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B . 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C . 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
D . 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
下面是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。

在上述实验过程中,所涉及的三次分离操作分别是( )
A . ①蒸馏 ②过滤 ③分液
B . ①分液 ②蒸馏 ③蒸馏
C . ①蒸馏 ②分液 ③分液
D . ①分液 ②蒸馏 ③结晶、过滤
下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO(g) | CO2(g) | NaOH溶液、浓硫酸 | 洗气 |
B | Cl2(g) | HCl(g) | 饱和食盐水、浓硫酸 | 洗气 |
C | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
D | Na2CO3(s) | NaHCO3(s) | 灼烧 |
A . A
B . B
C . C
D . D
下列各组分类中,有错误的是( )
A . 碱:烧碱、碱石灰、纯碱
B . 分散系:溶液、胶体、浊液
C . 干燥剂:浓硫酸、生石灰、氯化钙
D . 物质分离方法:过滤、渗析、分馏
下列现象或事实可用同一化学原理说明的是( )
A . 氯化铵和碘都可以用加热法进行提纯
B . 氯水和二氧化硫气体均能使品红溶液褪色
C . 硫酸亚铁溶液与熟石灰在空气中久置后均会变质
D . 在高温条作下,Na2CO 3 和 CaCO3 均可与SiO2 反应生成CO2
除去下列物质中的杂质选用的试剂和方法最合理的是( )

A . A
B . B
C . C
D . D
PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

-
(1) 含铅废料中的PbO2 和PbSO4 中,铅的化合价分别为、。
-
(2) 酸溶过程中为了加快溶解速率,除了加入FeSO4 作催化剂外,还可采取的措施有(任写一种)。
-
(3) 滤液A 中含有的主要阳离子是(填离子符号)。
-
(4) 脱硫过程发生的主要反应的离子方程式为。
-
(5) 冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、和,检验沉淀是否洗涤干净的方法是。
-
(6) PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)
 NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:。
在不用指示剂的情况下,欲将氯化钙溶液中的盐酸除去,最好选用下列物质中的( )
A . 碳酸钙粉末
B . 生石灰粉末
C . 石灰水
D . 熟石灰粉末
下列去除杂质(括号内的物质为杂质)的方法中,错误的是( )
A . NaCl固体(I2):充分加热
B . Fe粉(Al):加入足量NaOH溶液,溶解后过滤
C . SiO2固体(CaO):加入足量稀HCl,溶解后过滤
D . CO2气体(HCl):通入饱和Na2CO3溶液,洗气后干燥
在实验室中,下列除去杂质的方法正确的是( )
A . 除去溴苯中的少量溴,可以加水后分液
B . 除去C2H5OH中的少量CH3COOH,可以加入饱和Na2CO3溶液,然后分液
C . 除去硝基苯中混有的少量浓 HNO3 和浓 H2SO4 , 可加入NaOH溶液,然后分液
D . 除去乙烯中混有 SO2 , 将其通入酸性 KMnO4 溶液中洗气
写出下列对应的化学符号
-
(1) 2个硝酸根离子
-
(2) 铁锈的主要成分 熟石灰的化学式
-
(3) 硫原子的结构示意图硫化钠中硫元素的化合价
-
(4) 除去氯化钠溶液中的氢氧化钠和碳酸钠,可加入的试剂是反应的化学方程式是;;
-
(5) 实验室制取二氧化碳的化学方程式
为除去括号内的杂质,所选用的试剂或方法正确的是( )
A . NaCl固体(I2):加热固体
B . SiO2固体(Al2O3):加入足量氢氧化钠溶液后过滤
C . NO2气体(NO):通过盛有水的洗气瓶
D . SO2气体(HCl):通过盛有NaOH溶液的洗气瓶
利用制硫酸产生的矿渣(主要成分为  、
、  、
、 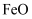 、
、  、
、  等)制备高纯氧化铁和副产品硫酸铵的流程如下:
等)制备高纯氧化铁和副产品硫酸铵的流程如下:
 、
、  、
、 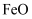 、
、  、
、  等)制备高纯氧化铁和副产品硫酸铵的流程如下:
等)制备高纯氧化铁和副产品硫酸铵的流程如下: 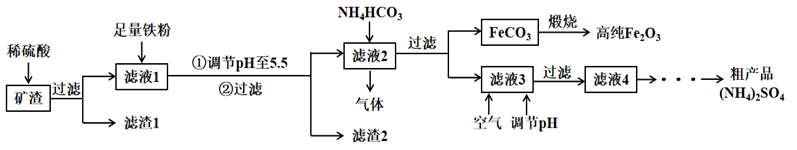
已知硫酸铵在水中的溶解度:  时
时  ,
, 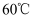 时
时 
-
(1) 矿渣酸浸时需加适当过量的稀硫酸的目的是。
-
(2) “滤液2”中加入碳酸氢铵溶液,写出生成
 的离子方程式,获得的
的离子方程式,获得的  需要用水洗涤,检验沉淀是否洗涤干净的方法是。
需要用水洗涤,检验沉淀是否洗涤干净的方法是。
-
(3) “滤渣2”的成分为铁粉和。
-
(4) “滤液3”中持续通入空气并调
 的目的是“除杂”,持续入空气的作用是。
的目的是“除杂”,持续入空气的作用是。
-
(5) “滤液4”经过、过滤得到粗产品,浓缩时若温度过高,产品中将混有少量
 ,试用化学平衡移动原理解释其原因。
,试用化学平衡移动原理解释其原因。
为提纯物质(括号内的物质为杂质),下列选项所选用除杂试剂和分离方法都正确的是( )
| 选项 | A | B | C | D |
| 被提纯物质 | 乙醇(水) | 苯(甲苯) | 乙烷(乙烯) | 溴苯(溴) |
| 除杂试剂 | 生石灰 | 硝酸 | 酸性高锰酸钾溶液 | KI溶液 |
| 分离方法 | 蒸馏 | 过滤 | 洗气 | 分液 |
A . A
B . B
C . C
D . D
用下列实验装置和方法进行相应实验,不能达到实验目的的是( )
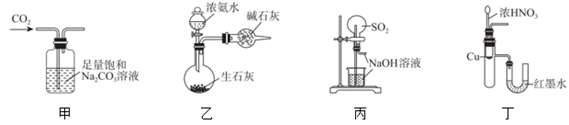
A . 用甲装置除去CO2中含有的少量HCl
B . 用乙装置制备干燥的氨气
C . 用丙装置做SO2的喷泉实验
D . 用丁装置验证Cu与浓硝酸反应的热量变化
常温下氯化铜为浅绿色固体,易潮解,实验室设计如下实验制备无水氯化铜。

A B C D
回答下列问题:
-
(1) 盛放浓盐酸的仪器名称为。
-
(2) 实验操作的先后顺序为(填选项字母)。
a.点燃A处酒精灯 b.点燃C处酒精灯 c.按图连接装置 d.向装置中添加相应药品 e.检查装置气密性
-
(3) 装置A中发生反应的离子方程式为。
-
(4) 填写表中装置加入试剂的目的。
装置序号
加入的试剂
加入该试剂的目的
B
浓
D
 溶液
溶液 -
(5) 某同学提出该装置存在缺陷,应增加一个干燥装置,该装置应该加在______(填序号)。A . A与B之间 B . B与C之间 C . C与D之间 D . D之后
-
(6) 用改进后的装置进行实验,若C中开始时加入Cu粉6.40g,反应结束后,得到12.79g固体(设除
 外,Cu未与其他物质发生反应),则固体中
外,Cu未与其他物质发生反应),则固体中 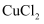 的物质的量为。
的物质的量为。
下列实验操作能达到实验目的的是( )
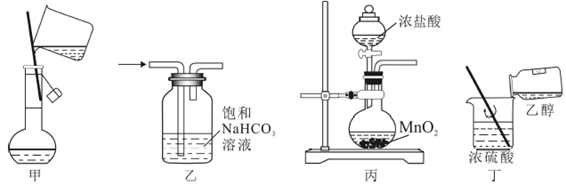
A . 将4.0g  固体置于100mL甲容器中,加水至刻度,配制
固体置于100mL甲容器中,加水至刻度,配制 
 溶液
B . 用装置乙除去实验室所制
溶液
B . 用装置乙除去实验室所制  中的少量
中的少量  C . 实验室用丙装置制备氯气
D . 丁装置用于混合浓硫酸和乙醇
C . 实验室用丙装置制备氯气
D . 丁装置用于混合浓硫酸和乙醇
 固体置于100mL甲容器中,加水至刻度,配制
固体置于100mL甲容器中,加水至刻度,配制 
 溶液
B . 用装置乙除去实验室所制
溶液
B . 用装置乙除去实验室所制  中的少量
中的少量  C . 实验室用丙装置制备氯气
D . 丁装置用于混合浓硫酸和乙醇
C . 实验室用丙装置制备氯气
D . 丁装置用于混合浓硫酸和乙醇
下列说法正确的是( )
A . 蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处
B . 用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量
C . 可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大
D . 向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键
最近更新



