尾气处理装置 知识点题库
有关X气体的收集及其尾气处理的装置如图所示,下列选项合理的是( )
选项 | X气体 | Y液体 |
A. | NO2 | 氢氧化钠溶液 |
B. | NH3 | 水 |
C. | NO | 水 |
D. | SO2 | 浓硫酸 |
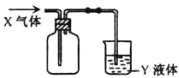
A . A
B . B
C . C
D . D
已知NH3难溶于CCl4 , 如图所示,下列装置中,不宜用于吸收氨气的是( )
A . 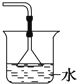
B .
B . 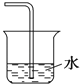
C .
C . 
D .
D . 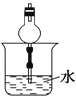

B .
B . 
C .
C . 
D .
D . 
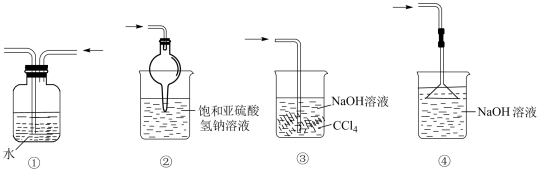
关于下列各实验装置图的叙述中,正确的是( )
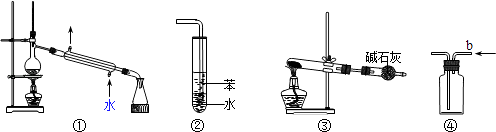
A . 装置①可用于分离苯和溴苯的混合物
B . 装置②可用于吸收HCl或NH3气体
C . 装置③可用于分解NH4Cl制备NH3
D . 装置④b口进气可收集CO2或NO气体
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置②实验室中做氯气与钠的反应实验时采用图所示装置③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验④实验室中采用图所示装置进行铜与稀硝酸的反应( )
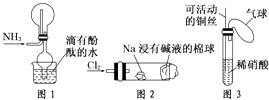
A . ②③④
B . ①②③
C . ①②④
D . ①③④
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
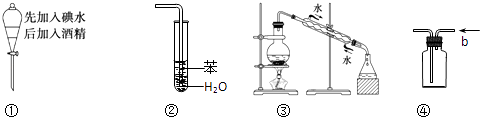
A . 溶液上层无色,下层紫红色
B . 装置②可用于吸收HCl气体,并防止倒吸
C . 装置③可用于制取蒸馏水
D . 装置④b口进气可收集H2、CO2等气体
实验是化学研究的基础.下列关于各实验装置的叙述正确的是( ) 

A . 装置③可用于收集H2、CO2、Cl2、NH3等气体
B . 装置②可用于吸收NH3或HCl气体,并防止倒吸
C . 装置①常用于分离互不相溶的液体混合物
D . 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
用下列实验装置进行相应实验,能达到实验目的是( )
A . 用图所示装置除去Cl2中含有的少量HCl  B . 用图所示装置蒸干NaHCO3溶液制备NaHCO3晶体
B . 用图所示装置蒸干NaHCO3溶液制备NaHCO3晶体  C . 用图所示装置制取少量纯净的CO2气体
C . 用图所示装置制取少量纯净的CO2气体  D . 用图所示装置分离CCl4萃取碘水后的液态混合物
D . 用图所示装置分离CCl4萃取碘水后的液态混合物 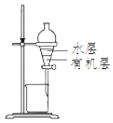
 B . 用图所示装置蒸干NaHCO3溶液制备NaHCO3晶体
B . 用图所示装置蒸干NaHCO3溶液制备NaHCO3晶体  C . 用图所示装置制取少量纯净的CO2气体
C . 用图所示装置制取少量纯净的CO2气体  D . 用图所示装置分离CCl4萃取碘水后的液态混合物
D . 用图所示装置分离CCl4萃取碘水后的液态混合物 
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A . 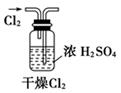 B .
B . 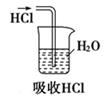 C .
C . 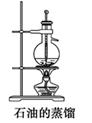 D .
D . 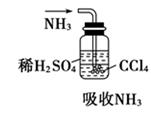
 B .
B .  C .
C .  D .
D . 
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
-
(1) 甲组的同学拟制备原料气NO和Cl2 , 制备装置如下图所示:

①制备NO发生装置可以选用(填写字母代号),请写出发生反应的离子方程式:。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ (按气流方向,用小写字母表示)。
-
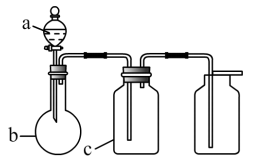
(2) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
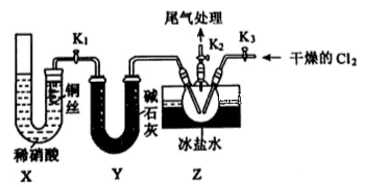
①实验室也可用X装置制备NO,X装置的优点为。
②检验装置气密性并装入药品,打开K2 , 然后再打开 ,通入一段时间气体,其目的为,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为。
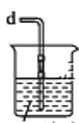
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 溶液。
-
(3) 取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOCl)的质量分数为(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(Ag2CrO4)=1×10-12]
四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2  TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
 TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题: 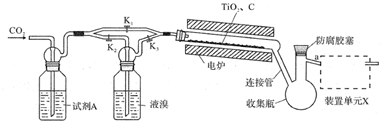
-
(1) 检查装置气密性并加入药品后,加热前应进行的操作是,其目的是,此时活塞K1 , K2 , K3的状态为;一段时间后,打开电炉并加热反应管,此时活塞K1 , K2 , K3的状态为。
-
(2) 试剂A为,装置单元X的作用是;反应过程中需用热源间歇性微热连接管,其目的是。
-
(3) 反应结束后应继续通入一段时间CO2 , 主要目的是。
-
(4) 将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为、承接管和接收瓶,在防腐胶塞上加装的仪器是(填仪器名称)。
氨基甲酸铵(  )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
 )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。 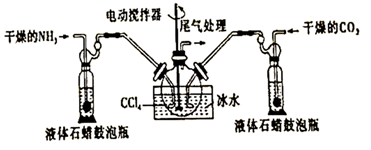
-
(1) 制备氨基甲酸铵的化学方程式为
-
(2) 三颈烧瓶用冰水冷却的原因是
-
(3) 液体石蜡鼓泡瓶的作用是
-
(4) 水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:(填“是”或“否”),理由:
-
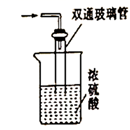
(5) 尾气处理装置如图所示,双通玻璃管的作用是,浓硫酸的作用是
-
(6) 取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为
下列实验中,所选装置或仪器不合理的是( )
A . 检查装置的气密性 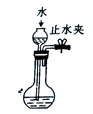 B . 吸收含Cl2的尾气
B . 吸收含Cl2的尾气 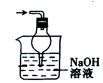 C . 分离出用H2O2制取O2后剩余的MnO2
C . 分离出用H2O2制取O2后剩余的MnO2 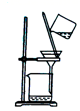 D . 量取15.00mLNaOH溶液
D . 量取15.00mLNaOH溶液 
 B . 吸收含Cl2的尾气
B . 吸收含Cl2的尾气  C . 分离出用H2O2制取O2后剩余的MnO2
C . 分离出用H2O2制取O2后剩余的MnO2  D . 量取15.00mLNaOH溶液
D . 量取15.00mLNaOH溶液 
已知FeCl3的熔点为306℃,沸点为315℃,易吸收空气里的水分而潮解,实验室制备FeCl3的装置如图所示。

回答下列问题:
-
(1) 装置A中仪器X的名称是,装置中发生反应的离子方程式为。
-
(2) 装置B中溶液为,C的作用是。
-
(3) 加热时,先点燃装置(填A或D)的酒精灯,当时,再点燃另一装置的酒精灯。
-
(4) 写出装置D制备FeCl3的化学方程式。
-
(5) 用粗硬质玻璃管直接连接装置D和E,比用细导管连接的优点是。
-
(6) 装置F中碱石灰的成分是NaOH和CaO混合物,其作用是防止空气中水蒸气进入装置E造成FeCl3潮解,同时还有的作用。
氮化锶(Sr3N2)常用于生产荧光材料,在潮湿环境中容易水解并产生一种具有刺激性气味的气体,实验室常用金属Sr与N2在加热条件下获得,某兴趣小组利用下图装置(夹持装置省略)制取Sr3N2。请回答下列问题:

-
(1) 装置B的名称是;装置D中长颈漏斗的作用是。
-
(2) 装置A中所发生反应的离子方程式为。实验室也经常使用加热Ca(OH)2与(填化学式)固体混合物的方法制备NH3。
-
(3) 装置C中CuO的作用是与NH3反应制备N2 , 该过程中氧化剂与还原剂的物质的量之比为。
-
(4) 装置E中所发生反应的化学方程式为。装置F的作用是。
-
(5) 金属Sr在加热条件下能与O2反应,故制备过程中,打开分液漏斗活塞后,应该先点燃(填“C”或“E”,后同)处酒精灯,一段时间后再点燃处酒精灯。
氯化亚砜(SOCl2)是一种液态化合物,沸点为78.8℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并产生有刺激性气味的气体。实验室合成原理:SO2+Cl2+SCl2=2SOCl2。其他相关信息如下:①实验室里通常用Na2SO3固体和浓硫酸在不加热时反应制备二氧化硫。②合成氯化亚砜时可能用到的部分装置如图所示。

回答下列问题:
-
(1) 装置乙、丙中相同的仪器名称为。
-
(2) 实验室制取SOCl2是在三颈烧瓶中合成的,从图中选取合适的装置组成整个装置,所选仪器的连接顺序是:⑥→→①②←(用“→”或“←”连接各接口,箭头表示气体流向,某些仪器可以多次使用。装置乙用于制取氯气)。
-
(3) 装置甲中冷凝管的进水口为(填“③”或“④”)。冷凝管上连接的干燥管的作用是:①吸收逸出的Cl2、SO2 , 防污染;②。
-
(4) 浓硫酸的作用是。
-
(5) 该实验制取氯气的离子方程式为。
-
(6) 实验室对SO2尾气进行处理,下列如图装置中最合适的是(填标号)。
-
(7) 已知SCl2的沸点为60℃。实验结束后,将三颈烧瓶中液体混合物分离开的实验操作名称是。若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl27.12g,则SOCl2的产率为(保留两位有效数字)。
如图a、b、c表示相应仪器中加入的试剂,可用图中装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 固体氢氧化钠 | 浓硫酸 |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
C | Cl2 | 浓盐酸 | 二氧化锰 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A . A
B . B
C . C
D . D
实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中不正确的是( )

A . ②③
B . ①③④
C . ①②④
D . ②③④
某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
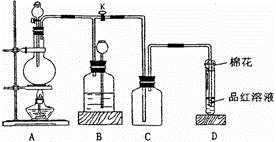
-
(1) 装置A中发生的化学反应方程式为;此反应表明浓硫酸具有(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
-
(2) 装置D中试管口放置的棉花中浸入溶液,其作用是。
-
(3) 装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
-
(4) 实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
下列有关氨气的制取、干燥、收集和吸收的实验装置或操作能达到目的的是( )
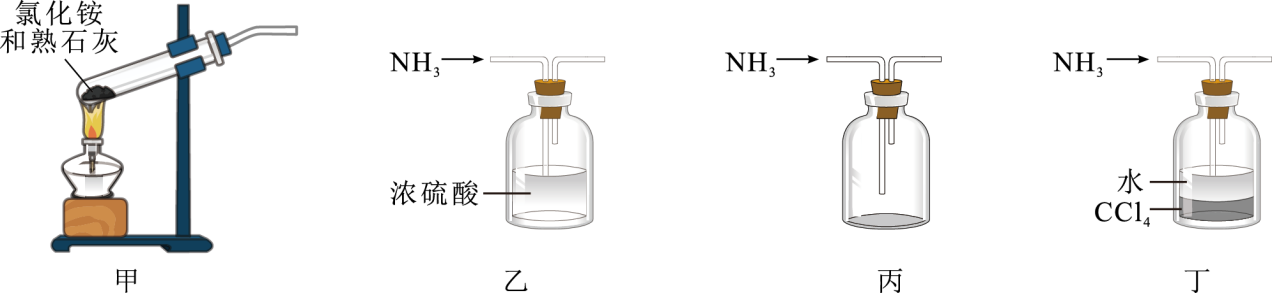
A . 用装置甲制取氨气
B . 用装置乙干燥氨气
C . 用装置丙收集氨气
D . 用装置丁吸收氨气
下列实验装置或实验操作正确,且能完成相应实验的是( )

A . 按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯
B . 利用图乙所示装置收集NO气体
C . 将 通入图丙所示装置中进行尾气吸收
D . 利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
通入图丙所示装置中进行尾气吸收
D . 利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
 通入图丙所示装置中进行尾气吸收
D . 利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
通入图丙所示装置中进行尾气吸收
D . 利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
最近更新



