离子共存 知识点题库
 、Cl﹣
C . 中性溶液中:SO
、Cl﹣
C . 中性溶液中:SO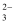 、S2﹣、Fe3+、Cl、能大量共存
D . 能使红色酚酞变无色的溶液:K+、Ca2+、Cl﹣、HCO
、S2﹣、Fe3+、Cl、能大量共存
D . 能使红色酚酞变无色的溶液:K+、Ca2+、Cl﹣、HCO
 、Na+
C . 含大量NO3﹣的溶液:Fe3+、Al3+、SO32﹣、H+
D . 能够与金属Al常温下反应放出气体的溶液:HCO
、Na+
C . 含大量NO3﹣的溶液:Fe3+、Al3+、SO32﹣、H+
D . 能够与金属Al常温下反应放出气体的溶液:HCO  、Na+、Ca2+、Cl﹣
、Na+、Ca2+、Cl﹣
①pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位
②1L 0.50mol•L﹣1NH4Cl 溶液与2L 0.25mol•L﹣1 NH4Cl 溶液含NH4+ 物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl﹣、I﹣、AlO2﹣、CO32﹣、NO3﹣、SiO32﹣中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32﹣
④pH=4、浓度均为0.1mol•L﹣1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO﹣)﹣c(CH3COOH)=2×(10﹣4﹣10﹣10) mol/L.
①无色溶液中:K+ Cl﹣ Mg2+ SO42﹣ Cr2O72﹣
②pH=11的溶液中:CO32﹣ Na+ AlO2﹣ NO3﹣ S2﹣
③水电离的H+浓度为10﹣2mol/L的溶液中:Cl﹣ CO32﹣ NH4+ SO32﹣ NO3﹣
④加入铝粉放出氢气的溶液中:K+ Cl﹣ Mg2+ S2O32﹣SO42﹣NH4+
⑤使甲基橙变红的溶液中:MnO4﹣Fe2+ Na+ NO3﹣SO42﹣
⑥中性溶液中:Fe3+ Al3+ NO3﹣ Cl﹣
⑦能溶解铜粉的溶液:I﹣ NO3﹣SO42﹣Fe3+ Al3+ .
-
(1) Ⅰ.离子反应和氧化还原反应都是高中化学中重要的反应类型。回答下列问题:
在发生离子反应的反应物或生成物中,一定存在有。(填序号)
①单质 ②化合物 ③氧化物 ④酸 ⑤碱 ⑥盐 ⑦电解质
-
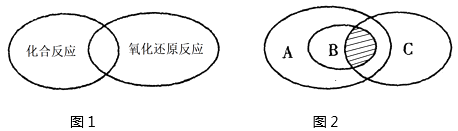
(2) 人们常用图示法表示不同反应类型之间的关系,如化合反应和氧化还原反应的关系可用图1表示。图2为离子反应、氧化还原反应和置换反应三者之间的关系,则表示置换反应的是(填字母),请写出符合图2阴影部分的一个离子方程式。
-
(3) Ⅱ.现有失去标签的四瓶无色溶液A,B,C,D,只知它们是K2CO3 , K2SO4 , NaHSO4和Ba(NO3)2 , 为鉴别它们,进行如下实验:
①A+D→溶液+气体 ②B+C→溶液+沉淀
③B+D→溶液+沉淀 ④A+B→溶液+沉淀
⑤将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,请完成如下问题:
写出各物质化学式:A;B;C;D。
-
(4) 写出实验③中反应中相关的离子方程式。。
-
(5) 书写离子方程式
①NaHCO3溶液与H2SO4溶液混合:。
②向石灰水中通入过量二氧化碳。
③氢氧化亚铁和浓盐酸反应。
④醋酸溶液和碳酸镁悬浊液混合生成气体并得到澄清溶液。
①pH=0的溶液:Na+、C2O42-、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③由水电离出的H+浓度c(H+)水=10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
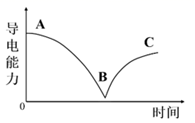
 =BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、
=BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、  和Cl-可以大量共存
和Cl-可以大量共存
 ]
] 
下列说法错误的是( )
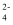 )+3c(AsO
)+3c(AsO 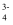 )
D . pH=11时溶液中离子浓度:c(HAsO
)
D . pH=11时溶液中离子浓度:c(HAsO 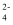 )>c(AsO
)>c(AsO 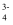 )>c(H2AsO
)>c(H2AsO  )
)
 、
、  、
、  、
、  、
、  、
、  中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离)
中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离) ⑴一份固体溶于水得无色透明溶液,加入足量  溶液,得沉淀4.30 g,在沉淀中加入过量稀盐酸,仍有2.33 g沉淀。
溶液,得沉淀4.30 g,在沉淀中加入过量稀盐酸,仍有2.33 g沉淀。
⑵另一份固体与过量NaOH固体混合后充分加热,产生  (标准状况)。
(标准状况)。
下列说法正确的是( )
 B . 该固体中一定含有
B . 该固体中一定含有  、
、  、
、  、
、  C . 该固体中只含有
C . 该固体中只含有  、
、  、
、  、
、  D . 该固体中一定没有
D . 该固体中一定没有  、
、  、
、 
 、
、  、
、  、
、  B .
B .  、
、 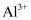 、
、  、
、  C .
C .  、
、  、
、  、
、  D .
D . 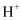 、
、  、
、  、
、 



