电离方程式的书写 知识点题库
写出下列物质的电离方程式:
H2SO4 Ba(OH)2 Na2SO4
已知0.1mol/L NaHSO4溶液中H+的物质的量浓度为0.1mol/L,请回答下列问题:
(1)写出NaHSO4 在水溶液中的电离方程式 .
(2)NaHSO4应属于 (填酸、碱、盐),你选择的理由是
(3)若将NaHSO4 与Ba(OH)2在溶液中按物质的量之比2:1 混合,该反应的离子方程式是
下列电离的方程式,正确的是( )
A . CH3COOH═CH3COO﹣+H+
B . NaOH═Na++OH﹣
C . H2SO4═H++SO  D . KClO3═K++Cl﹣+3O2﹣
D . KClO3═K++Cl﹣+3O2﹣
 D . KClO3═K++Cl﹣+3O2﹣
D . KClO3═K++Cl﹣+3O2﹣
下列电离或水解方程式书写正确的是( )
A . NaHCO3═CO32﹣+H++Na+
B . S2﹣+H2O⇌H2S+2 OH﹣
C . H3PO4⇌3H++PO43﹣
D . NH3•H2O⇌NH4++OH﹣
下列电离方程式中,正确的是( )
A . NaOH=Na++OH﹣
B . Na2SO4=2Na++SO4﹣2
C . H2SO4=H2++SO42﹣
D . Ca(NO3)2=Ca2++2(NO3)2﹣
下列电离方程式书写不正确的是( )
A . 2H2O⇌H3O++OH﹣
B . H2S⇌H++HS﹣
C . NaHS=Na++HS﹣
D . HCO3﹣=H++CO32﹣
下列各式中不正确的是( )
A . HF+H2O⇌H3O++F﹣
B . NaHCO3=Na++HCO3﹣ , HCO3﹣⇌H++CO32﹣
C . Ag2S(s)⇌2Ag+(aq)+S2﹣(aq)
D . S2﹣+2H2O⇌H2S+2OH﹣
用适当的化学用语来表示下列反应原理
-
(1) 氢氧化亚铁放置于空气中,颜色发生改变,有关化学方程式:;
-
(2) 小苏打溶于水,其电离方程式:;
-
(3) 铁红中铁的化合价为:,它与盐酸反应的离子方程式为;
-
(4) 明矾[KAl(SO4)2•12H2O]能净水是由于其溶于水后生成了(写化学式);
-
(5) 工业上制取漂白液,有关离子方程式并用双线桥标明电子得失:.
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A . -67.7 kJ·mol-1
B . -43.5 kJ·mol-1
C . +43.5 kJ·mol-1
D . +67.7 kJ·mol-1
一定温度条件下,N2与H2反应生成NH3的过程中能量变化曲线如下图。

-
(1) 曲线(填“a“或“b”")是加入催化剂时的能量变化曲线, N≡N键能为946kJ/mol,N-H键能为391kJ/mol,则H-H建能为kJ/mol。
-
(2) 水的自偶电离方程式为2H2O
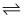 H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式;NH2-电子式为。
H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式;NH2-电子式为。
-
(3) 次氯酸钠溶液中离子浓度由大到小顺序为;将氨气通入到次氯酸钠溶液中可制得联氨(N2H4),写出反应的离子方程式;用四氧化二氮作助燃剂,联氨可作火箭燃料。已知:N2(g)+2O2(g)= 2NO2(g),ΔH,= +67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;N2O4(g)=2NO2(g),ΔH3=+ 57kJ/mol,写出气态的联氨在四氧化二氮气体中燃烧生成两种无污染气态产物的热化学方程式 。
-
(4) 将2.04mol/L的氨水与0.02mo/L的硝酸银溶液等体积混合得到混合溶液,混合体系中存在平衡:Ag+(aq) +2NH3·H2O(aq)
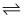 Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=mol/ L。
Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=mol/ L。
下列选项中正确的是()
A . 钠原子的结构示意图:  B . 过氧化钠的电子式:
B . 过氧化钠的电子式:  C . 碳酸氢钠的电离方程式:NaHCO3= Na++ H+ + CO32-
D . 中子数为12的钠的核素符号为:
C . 碳酸氢钠的电离方程式:NaHCO3= Na++ H+ + CO32-
D . 中子数为12的钠的核素符号为: 
 B . 过氧化钠的电子式:
B . 过氧化钠的电子式: 
下列物质在水溶液中的电离方程式错误的是( )
A . NaHCO3=Na++H+ +CO32-
B . NaHSO4=Na+ +H+ +SO42-
C . MgCl2=Mg2++2Cl-
D . Ba(OH)2=Ba2+ +2OH-
现有下列物质:①稀硫酸②小苏打③氨水④二氧化碳⑤FeCl3固体⑥稀NaOH溶液⑦硝酸亚铁溶液。
-
(1) 上述物质中属于电解质的物质序号为
-
(2) 物质①可以导电,其电离方程式为
-
(3) 向⑥中通入过量④的离子方程式为
下列物质的电离方程式书写正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
有下列物质:①CuSO4·5H2O ②KHSO4 ③液态HCl ④稀硫酸 ⑤二氧化碳 ⑥铜 ⑦蔗糖 ⑧熔融氯化钠。请回答下列问题:
-
(1) 可以导电的有(填序号)。
-
(2) 属于电解质的有(填序号)。
-
(3) 属于非电解质的有(填序号)。
-
(4) ②在水中的电离方程式为。
下列离子方程式书写正确的是( )
A . Na2O2与水反应:2  +2H2O=4OH-+O2↑
B . CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+
C . NH4HCO3溶液中加入足量的NaOH溶液:
+2H2O=4OH-+O2↑
B . CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+
C . NH4HCO3溶液中加入足量的NaOH溶液:  +OH-=
+OH-=  +H2O
D . 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
+H2O
D . 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
 +2H2O=4OH-+O2↑
B . CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+
C . NH4HCO3溶液中加入足量的NaOH溶液:
+2H2O=4OH-+O2↑
B . CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+
C . NH4HCO3溶液中加入足量的NaOH溶液:  +OH-=
+OH-=  +H2O
D . 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
+H2O
D . 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
-
(1) Ⅰ.现有下列10种物质:①铝,②纯醋酸,③CO2 , ④H2SO4 , ⑤NaOH,⑥硫酸铜溶液,⑦HCl,⑧NaHSO4 , ⑨碳酸氢钠,⑩乙醇。
上述物质中属于非电解质的有(填序号)。
-
(2) 向⑥中加入过氧化钠固体,看到的现象是。
-
(3) ⑧在水中的电离方程式为。
-
(4) ②和⑤的溶液混合,反应的离子方程式为。
-
(5) ⑦的浓溶液与软锰矿反应制取氯气的离子方程式为。
-
(6) Ⅱ.已知离子还原性Br-<Fe2+<I- , 则氧化性Fe3+I2(填“>”“=”或“<”),有一混合溶液,其中只含有Fe2+、Br-、I- , 其中Br-、I-的个数比为3:4,向该溶液中通入少量氯气,一定会发生的反应的离子方程式是。如果要使溶液中Br-、I-的个数比为3:1,通入氯气与溶液中剩余Fe2+的物质的量之比为。
下列化学用语书写错误的是( )
A . N2的电子式: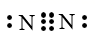 B . KNO3的电离方程式:KNO3=K++
B . KNO3的电离方程式:KNO3=K++ C . 用电子式表示NaCl的形成过程:
C . 用电子式表示NaCl的形成过程: D . H2还原CuO反应中电子的转移:
D . H2还原CuO反应中电子的转移:
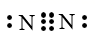 B . KNO3的电离方程式:KNO3=K++
B . KNO3的电离方程式:KNO3=K++ C . 用电子式表示NaCl的形成过程:
C . 用电子式表示NaCl的形成过程: D . H2还原CuO反应中电子的转移:
D . H2还原CuO反应中电子的转移:
回答下列问题:
-
(1) 写出
 的电离方程式。
的电离方程式。
-
(2) 用离子方程式表示氯化铵溶液呈酸性的原因。
-
(3) 向
 沉淀中加入足量
沉淀中加入足量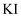 溶液,固体由白色逐渐变为黄色,请写出该过程的离子方程式。
溶液,固体由白色逐渐变为黄色,请写出该过程的离子方程式。
-
(4) ①已知
 和
和 时,液态甲醇
时,液态甲醇 的燃烧热
的燃烧热 , 请写出表示甲醇燃烧的热化学方程式;
, 请写出表示甲醇燃烧的热化学方程式;②根据甲醇在酸性电解质中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极的电极反应式是。
下列化学用语表示正确的是( )
A . 铝离子Al3+的结构示意图: B . 乙烯的分子式:CH2=CH2
C . 硫化氢的电子式:
B . 乙烯的分子式:CH2=CH2
C . 硫化氢的电子式: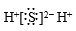 D . NaOH的电离方程式:NaOH=Na++OH-
D . NaOH的电离方程式:NaOH=Na++OH-
最近更新



