电离方程式的书写 知识点题库
下列电离方程式中正确的是( )
A . NaHCO3=Na++HCO3-
B . Na2SO4=2Na++SO4-2
C . Ca(NO3)2=Ca2++2(NO3)2-
D . KClO3=K++Cl-+3O2-
已知:(1)Al(OH)3的电离方程式为:AlO2﹣+H++H2O  Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
 Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
Al(OH)3=Al3++3OH﹣(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A . 均为强电解质
B . 均为弱电解质
C . 均为离子化合物
D . 均为共价化合物
下列物质在水中的电离方程式错误的是( )
A . MgSO4=Mg2++SO  B . Ba(OH)2=Ba2++OH2﹣
C . NaHCO3=Na++HCO
B . Ba(OH)2=Ba2++OH2﹣
C . NaHCO3=Na++HCO  D . H2SO4=2H++SO
D . H2SO4=2H++SO 
 B . Ba(OH)2=Ba2++OH2﹣
C . NaHCO3=Na++HCO
B . Ba(OH)2=Ba2++OH2﹣
C . NaHCO3=Na++HCO  D . H2SO4=2H++SO
D . H2SO4=2H++SO 
下列电离方程式中正确的是( )
A . KOH═K++OH﹣
B . NaHCO3═Na++H++CO32﹣
C . H2SO4═2H++SO42﹣
D . Fe2(SO4)3═Fe23++3SO42﹣
下列电离方程式错误的是( )
A . Ba(NO3﹣)2=Ba2++( NO3﹣) 2
B . NaHSO4=Na++H++SO42﹣
C . H2SO4=2H++SO42﹣
D . KClO3=K++ClO3﹣
根据题意解答
-
(1) 下列物质能导电是,属于电解质是.属于非电解质的是.(填序号,多选或错选扣分)
①水银②烧碱③硫酸钡④氯化钠晶体⑤盐酸⑥蔗糖
-
(2) 按要求完成下列各题:
①Na2SO3在水溶液中的电离方程式:
②NaHCO3在水溶液中的电离方程式:
③硫酸和氢氧化钡溶液反应的离子方程式:.
下列电离方程式不正确的是( )
A . NH4NO3=NH4++NO3﹣
B . CH3COOH=H++CH3COO﹣
C . NH3•H2O⇌NH4++OH﹣
D . NaHCO3=Na++HCO3﹣
下列有关化学用语表示正确的是( )
A . 四氯化碳分子的电子式为:  B . Cl﹣的结构示意图:
B . Cl﹣的结构示意图:  C . 醋酸的电离方程式:CH3COOH+H2O⇌CH3COO﹣+H3O+
D . 聚丙烯的结构简式:
C . 醋酸的电离方程式:CH3COOH+H2O⇌CH3COO﹣+H3O+
D . 聚丙烯的结构简式: 
 C . 醋酸的电离方程式:CH3COOH+H2O⇌CH3COO﹣+H3O+
D . 聚丙烯的结构简式:
C . 醋酸的电离方程式:CH3COOH+H2O⇌CH3COO﹣+H3O+
D . 聚丙烯的结构简式:
①写出Na2SO4的电离方程式.
②氧化铝和氢氧化钠溶液反应的离子反应方程式.
③OH﹣+H+═H2O改写为化学方程式.
下列物质的电离方程式书写正确的是( )
A . Na2SO4═Na++SO42﹣
B . Ba(OH)2═Ba2++(OH)22﹣
C . CH3COOH═CH3COO﹣+H+
D . NH4Cl═NH4++Cl﹣
下列电离方程式正确的是( )
A . H2CO3⇌2H++CO32﹣
B . NH3•H2O⇌NH4++OH﹣
C . Fe(OH)3=Fe3++3OH﹣
D . NaHSO4  Na++H++SO42﹣
Na++H++SO42﹣
 Na++H++SO42﹣
Na++H++SO42﹣
下列物质溶于水的电离方程式正确的是( )
A . Al2(SO4)3 = 2Al3+ + 3SO42-
B . NaHCO3 = Na+ + H++ CO32-
C . NaHSO4= Na+ + HSO4-
D . KClO3 = K+ + Cl-+ 3O2-
下列表述错误的是( )
A . CS2的结构式为:S=C=S
B . 6CO2+6H2O 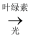 C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)
C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)  2CO(g)△H>0,△S>0,该反应常温下能自发进行
D . NH3水溶液呈碱性的原因是NH3+H2O
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D . NH3水溶液呈碱性的原因是NH3+H2O  NH3·H2O
NH3·H2O  NH4++OH-
NH4++OH-
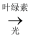 C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)
C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)
氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生成氮肥的原料。回答下列问题:
-
(1) 氮气的电子式 ,氨的结构式;
-
(2) 氨水显碱性,写出氨水的电离方程式;
-
(3) 氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:。
下列化学用语表达正确的是( )
A . 氧的原子结构示意图:  B . 氯化钠溶于水的电离方程式:NaCl=Na++Cl-
C . 氯化氢的电子式:
B . 氯化钠溶于水的电离方程式:NaCl=Na++Cl-
C . 氯化氢的电子式: 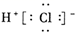 D . 乙烯的分子式:CH2CH2
D . 乙烯的分子式:CH2CH2
磷及其化合物在生产、生活中有重要的用途。回答下列问题:
-
(1) 写出磷酸主要的电离方程式:。
-
(2) 在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
 +Ag++=
+Ag++=  +Ag+
+Ag+ -
(3) 由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44 ℃,沸点280 ℃),主要生产流程如下:
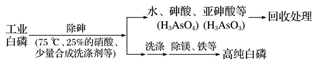
①除砷过程在75 ℃时进行,其合理的原因是(填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是。
③硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:。
氧化相同质量的砷,当转化为亚砷酸的量越多时,消耗硝酸的量越(填“多”或“少”)。
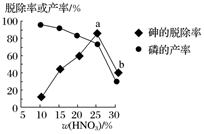
④某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是。
下列说法正确的是( )
A . 次氯酸的电离方程式是HClO=H++ClO-
B . 醋酸是弱电解质,液态时能导电
C . 0.1 mol·L-1氨水中NH4+的浓度小于0.1 mol·L-1
D . 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱
下列电离方程式书写正确的是( )
A . H2SO4=H2++SO42-
B . NaOH=Na++O2-+H+
C . Ba(OH)2=Ba2++OH2-
D . CaCl2=Ca2++2Cl-
下列溶液中,电离方程式书写正确的是( )
A . NaOH=Na++O2-+H+
B . FeCl3=Fe3++Cl-
C . NaHCO3=Na++H++CO  D . NaHSO4=Na++H++SO
D . NaHSO4=Na++H++SO 
 D . NaHSO4=Na++H++SO
D . NaHSO4=Na++H++SO 
25℃时有以下 5 种溶液:①0.10mol/LHCl 溶液②0.10mol/LCH3COOH 溶液③0.10mol/LNaOH 溶液④0.10mol/LNH4Cl 溶液⑤饱和 FeCl3 溶液。
-
(1) 溶液①的 pH7(填“>”、“<”或者“=”)。
-
(2) 写出 CH3COOH 的电离方程式。
-
(3) 将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是
-
(4) 用广泛pH 试纸测得④的 pH=5,请结合化学用语对 NH4Cl 溶液显酸性的原因进行完整说明。
-
(5) 加热⑤可制备 Fe(OH)3 胶体,请结合化学用语解释。
最近更新



