探究铝与酸、碱溶液的反应 知识点题库
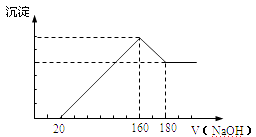
求:
-
(1) 加入NaOH溶液0--20mL过程中反应方程式为:。
160--180mL过程中反应方程式为。
-
(2) 合金中Mg的质量为g。所用HCl 的物质的量浓度为mol/L。
①SiO2 ②Al ③Al2O3 ④Al(OH)3
⑤Na2CO3溶液 ⑥Ca(HCO3)2溶液 ⑦NH4HCO3溶液 ⑧KHSO4溶液
| A | B | C | D |
| 向NaAlO2溶液中逐滴滴加盐酸至过量 | 向AlCl3溶液中逐滴滴加氨水至过量 | 向明矾溶液中逐滴滴加 Ba(OH)2溶液至过量 | 向澄清石灰水中缓缓通入CO2至过量 |
| | | | |
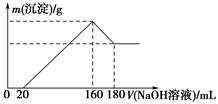
-
(1) 加入NaOH溶液0~20 mL时的反应的离子方程式为,160~180 mL时的反应的离子方程式为。
-
(2) 合金中Mg的质量为g,所用HCl的物质的量浓度为mol/L。
(实验目的)探究 金属的成分
-
(1) (提出假设)猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是;
猜想4:M的成分是铁、铜和铝
-
(2) (设计实验)取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1L和V2L(所测定的气体体积已折合成标准状况)。
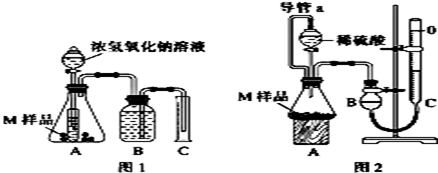
完成实验目的和猜想填空内容。
若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度(填“偏大”、“偏小”或“无影响”)
-
(3) 进行实验1前,B瓶中的水没有装满,使测得的气体体积 (填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
-
(4) 若V1≠0,则推测上述猜想 (填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1V2(填“>”、“<”或“=”)。
-
(5) 若V1<V2≠0,则M样品中铁的质量为g(用含V1和V2式子表示)
 、Fe3+、Ba2+、Mg2+、
、Fe3+、Ba2+、Mg2+、  、I-、OH-、
、I-、OH-、  。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是( )
。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是( )

①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
-
(1) Ⅰ.如图为实验室某浓盐酸试剂瓶标签上的有关数据。
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
HCl的质量分数:36.5%
该浓盐酸中,HCl的物质的量浓度为mol/L。
-
(2) 取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是___________(填标号)。A . 溶液的密度 B . 溶质HCl的物质的量 C . 溶质HCl的物质的量浓度 D . 溶液中Cl-的物质的量
-
(3) 用该浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸。
①需量取mL该浓盐酸进行配制(保留1位小数)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)。用量筒量取浓盐酸时俯视观察凹液面:。定容后经振荡、摇匀、静置,发现液面略有下降,再加适量的蒸馏水到容量瓶颈部的刻度线:。
-
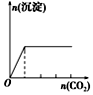
(4) Ⅱ.将一定量的镁铝合金投入100mL一定浓度的盐酸中,充分反应,合金全部溶解。向合金溶解后所得溶液中滴加5mol/L NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示[已知:Mg(OH)2不溶于NaOH溶液;Al(OH)3能溶于NaOH溶液,反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O]。
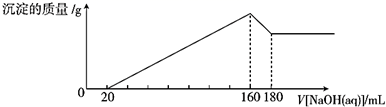
原合金中,镁的质量为g,铝的质量为g。
-
(5) 盐酸溶液中溶质的物质的量浓度为mol/L。
选项 | 操作 | 目的 |
A | 除去 | 向混合物中加入足量NaOH溶液,充分反应后过滤、洗涤、干燥 |
B | 测定相同浓度的HCl溶液、HBr溶液的pH | 比较Cl和Br的非金属性强弱 |
C | 将相同大小的镁片和铝片用导线连接,插入NaOH溶液中 | 证明原电池中活泼性较强的金属作负极 |
D | 向蔗糖溶液中加入新制的银氨溶液,水浴加热 | 证明蔗糖是非还原性糖 |
 中的
中的 杂质
杂质


