硅酸的性质及制法 知识点题库
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si + 3HCl  SiHCl3+ H2
SiHCl3+ H2
③SiHCl3与过量H2在 1000 ~1100℃反应制得纯硅
已知 ①SiHCl3能与 H2O强烈反应,在空气中易自燃②普通玻璃在600℃左右融化。
请回答下列问题:
-
(1) 第①步制备粗硅的化学反应方程式为 。
-
(2) 粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点57.6℃)
和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为 。
-
(3) 用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去):
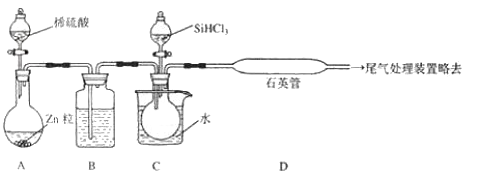
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是。
②反应一段时间后,装置 D中观察到的现象是 ,装置 D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是。
A 碘水 B 氯水 C NaOH溶液 D KSCN溶液 E Na2SO3 溶液
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃和水晶都是硅酸盐制品
③高纯度的硅单质厂泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
-
(1) 写出C与氢氟酸发生反应的化学方程式是
-
(2) 将C与纯碱混合高温熔融时反应生成D,同时还生成氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学方程式:、。
②要将NaOH高温熔化,下列坩埚中可选用的是。
a.普通玻璃坩埚
b.石英玻璃坩埚
c.氧化铝坩埚
d.铁坩埚
-
(3) 碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L。生成氢气的离子方程式为,硅酸盐的物质的量浓度为mol/L。
-
(4) 下列叙述正确的有(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 加热放在坩埚中的小块钠 | 生成淡黄色固体 | 产物是氧化钠 |
| B | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中一定含SO42- |
| C | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
| D | 向某溶液液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定含Fe2+ |
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液一定为钠盐溶液 |
| B | 用浓盐酸和石灰石反应产生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向某溶液中加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42- |

-
(1) 利用焦炭在电炉中还原二氧化硅的化学方程式为。
-
(2) 利用氢氟酸刻蚀玻璃的化学方程式为。
-
(3) 硅酸钠转化为原硅酸的离子方程式。
-
(4) 二氧化硅与烧碱溶液反应的化学方程式。
-
(5) 石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为。



