碘与人体健康 知识点题库
①菜烧好出锅前加盐
②先将盐、油放锅里加热,再加入食材烹饪
③煨汤时,将盐和食材一起加入
④先将盐放在热锅里炒一下,再加入食材烹饪.
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40mg/kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
-
(1) 要在食盐中加碘,是因为碘是人体内合成 激素的主要原料,缺碘会引起疾病.
-
(2) 食盐中加碘,这碘指的是 (填“单质”、“化合物”或“元素”),其中碘元素的化合价为
-
(3) 根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易
①维生素A又称维生素(填字母).
a.视黄醇,水溶性 b.抗坏血酸,水溶性 c.视黄醇,脂溶性
②下列药物中属于抗生素的是(填字母).
a.复方氢氧化铝片 b.阿司匹林 c.青霉素
③加碘盐中碘元素的存在形式是(填字母).
a. I2 b.KIO3 c.KI
④在食品加工或餐饮业中,特别要严加控制用量的物质是 (填字母).
a.亚硝酸钠 b.碳酸氢钠 c.氯化钠
⑤综合利用“地沟油”的一种方法是将它水解以获取高级脂肪酸和(填名称).
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
-
(1) 碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KIO3+KI+H2SO4═K2SO4+I2+H2O
-
(2) 上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是,上述操作正确的顺序是:(填序号)
-
(3) 已知:I2+2S2O32﹣═2I﹣+S4O62﹣ . 某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol•L﹣1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是.
②b中反应所产生的I2的物质的量是mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg.
①喝牛奶、豆浆等富含蛋白质的食品可有效缓解煤气中毒
②人体胃液的pH为0.9~1.5
③人体摄入过量的氟元素可导致龋齿
④人体中的酶都是在体温和中性条件下进行催化的
-
(1) 某研究小组用如图装置制备少量ClO2(夹持装置已略去)。
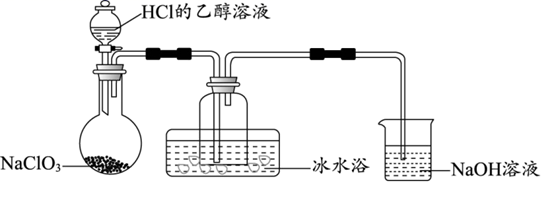
①冰水浴的作用是。
②NaOH溶液的主要作用为吸收反应产生的Cl2 , 其吸收液可用于制取漂白液,该吸收反应的离子方程式为,该反应的氧化剂与还原剂物质的量之比为。
③以NaClO3和HCl为原料制备ClO2 , 完成化学方程式。
-
(2) 将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量淀粉溶液,振荡、静置,观察到,证明ClO2具有氧化性。
-
(3) ClO2在杀菌消毒过程中会产生Cl- , 用0.0001mol·L-1的AgNO3标准溶液滴定至终点,测定自来水管中Cl-的含量。
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果(填“偏高”、“偏低”或“无影响”)。
-
(1) I.气相还原法—固体还原剂直接还原法
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如下:
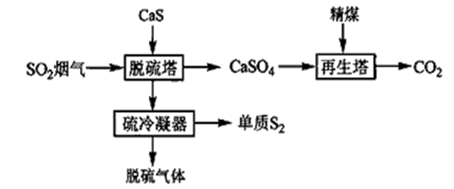
再生塔中生成的物质(填化学式)可在流程中循环使用。
-
(2) 脱硫塔中发生反应的化学方程式为。
-
(3) 脱硫过程中,当产生48g单质S2时,转移电子的物质的量为mol。
-
(4) II.液相还原法—液相催化歧化制硫法
Petrusevski等人用I¯作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
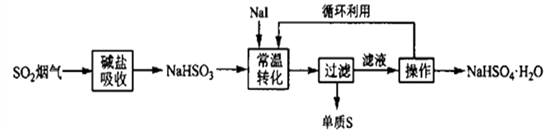
I¯催化NaHSO3的反应过程为,第一步(用离子方程式表示),第二步I2+HSO
 +H2O=2I¯+SO
+H2O=2I¯+SO  +3H+。
+3H+。 -
(5) III.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是以氮气为载体,以稀盐酸、淀粉和碘化钾的混合溶液为吸收液,用0.0010 mol·L-1KIO3标准溶液进行滴定。检测装置如图所示:
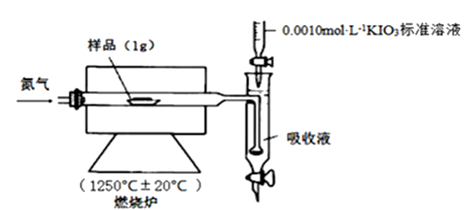
[查阅资料] ①实验进行5min样品中的S元素都可转化为SO2
②2IO
 +5SO2+4H2O = 8H++5SO
+5SO2+4H2O = 8H++5SO  +I2
+I2③I2+SO2+2H2O = 2I¯+SO
 +4H+
+4H+④IO
 +5I¯+6H+ = 3I2+3H2O
+5I¯+6H+ = 3I2+3H2O工业设定的滴定终点现象是(即吸收液的颜色变化)。
实验一:不放样品进行实验,5 min后测得消耗标准液体积为V1
实验二:加入1 g样品再进行实验,5 min后测得消耗标准液体积为V2
①比较数据发现V1远远小于V2 , 可忽略不计。则设置实验一的目的是。
②测得V2的体积如表:
序号
1
2
3
KIO3标准溶液体积/mL
10.02
9.98
10.00
该份铁矿石样品中硫元素的质量百分含量为。(百分数表示结果,保留三位小数)
-
(1) 实验室中制取少量碘可采用如下方法:KI+CuSO4→CuI↓+K2SO4+I2。此反应生成1 mol I2时转移的电子是mol。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应生成碘,写出此反应的离子方程式:。
-
(2) 单质碘与氟气反应可制得IF5 , 实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(类似于:2H2O
 H3O++OH-),电离生成的+1价阳离子为,-1价阴离子为。
H3O++OH-),电离生成的+1价阳离子为,-1价阴离子为。
-
(3) 将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体(AlI3),此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出AlI3和Na2CO3溶液反应的离子方程式:。
-
(4) 设计以下实验方案判断加碘食盐中碘的存在形式为I-、IO
 或两者同时存在。请对以下试验方案进行预测和分析。首先取试样加水溶解,分成三份试样:
或两者同时存在。请对以下试验方案进行预测和分析。首先取试样加水溶解,分成三份试样: ①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO
 ,该过程反应的离子方程式为。
,该过程反应的离子方程式为。②第二份试样酸化后,加入淀粉溶液无变化,再加溶液,溶液变蓝,说明试样中存在I-。
③第三份试样酸化后,如果直接使试纸变蓝,说明试样存在IO
 离子。
离子。
| 方案设计 | 现象 | 结论 | |
| A | 取一段长铝条,伸入 | 铝条表面无明显变化 | 铝活泼性比铜弱 |
| B | 向2mL碘水中加入4mL | 下层显紫红色 | |
| C | 向碳酸钠溶液中加少量稀酸HA溶液 | 无明显气泡逸出 | HA的酸性比碳酸的酸性弱 |
| D | 向装2mLNaOH浓溶液的试管中加入几滴溴苯,充分振荡 | 试管内液体分层,下层为无色油状液体 | 常温下溴苯不易发生水解反应 |
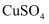 溶液
溶液 ,振荡后静置
,振荡后静置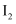 在
在 


