二氧化硫的性质 知识点题库
下列物质中的硫元素既有氧化性又有还原性的是( )
A . H2S
B . S
C . H2SO4
D . Na2SO4
下列物质中,不能使品红溶液褪色的是( )
A . Cl2
B . HCl
C . SO2
D . 活性炭
下列有关物质性质和应用的说法正确的是( )
A . 碳酸钠受热易分解,可用于生产食品发酵粉
B . 次氯酸钠具有强氧化性,可用于配制消毒液
C . 二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸
D . 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
下列实验过程中,始终无明显现象的是( )
A . Cl2通入FeSO4溶液中
B . CO2通入Ca(OH)2溶液中
C . 将AlCl3溶液滴入氨水溶液中
D . SO2通入BaCl2溶液中
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
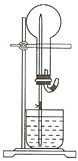
A . SO2(NaHSO3溶液) 无色喷泉
B . NH3(H2O含酚酞) 红色喷泉
C . H2S(CuSO4溶液) 黑色喷泉
D . HCl(AgNO3溶液) 白色喷泉
下列说法中错误的是( )
A . 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
B . 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀
C . 二氧化硫能漂白某些物质,说明它具有氧化性
D . 二氧化硫漂白过的草帽过一段时间后变黄
下列有关硫及其化合物的叙述中正确的是( )
A . 浓H2SO4可用于干燥Cl2 , 但不能干燥SO2
B . SO2具有漂白性,所以它能使碘的淀粉溶液由蓝色变为无色
C . 向Na2S2O3溶液中加入盐酸产生淡黄色沉淀
D . SO2和Cl2分别与双氧水反应均产生O2
下列说法正确的是( )
A . 在常温下,浓硫酸不与铜反应,是因为铜被钝化
B . 在BaCl2溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液有白色沉淀
C . 二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性
D . 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
下列有关说法正确的是( )
A . 氯气、二氧化硫都能使品红溶液褪色,它们的漂白原理相同
B . 纯净的晶体硅是现代光学及光纤制品的基本原料
C . 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体
D . NH3的水溶液可以导电,所以NH3是电解质
向BaCl2溶液中通入SO2气体,没有产生沉淀,继续通入另一种气体,产生沉淀,则通入的气体不可能是( )
A . CO2
B . NO2
C . Cl2
D . NH3
高中课本中有多处“科学探究”,下列说法正确的是( )
A . 将Fe(OH)3胶体和泥水分别进行过滤,分别得到Fe(OH)3沉淀和泥土
B . 将铝箔在酒精灯上加热至熔化,观察熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
C . SO2与CO2性质相似,其与Na2O2反应的化学方程式为:2SO2 + 2Na2O2 =2Na2SO3 + O2
D . 食醋浸泡有水垢的暖壶或水壶,清除其中的水垢的离子方程式:2H++CaCO3=Ca2++H2O+CO2↑
化学与人类生活密切相关。关于下列物质的使用不合理的是( )
A . 二氧化硫常用于食品增白
B . 碳酸氢钠常用于焙制糕点
C . 醋酸常用于除去水壶内的水垢
D . 氢氧化镁常用于治疗胃酸过多
列实验操作能达到实验目的的是()
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| B | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 证明SO2具有漂白性 | 把SO2通入紫色石蕊试液中 |
A . A
B . B
C . C
D . D
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m , 制备过程如图所示:下列说法错误的是 



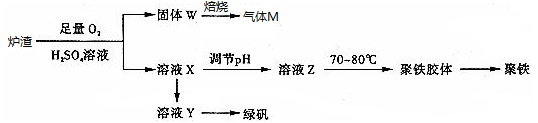
A . 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B . 气体M的成分是SO2 , 通入双氧水得到硫酸,可循环使用
C . 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D . 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
下列气体排放到空气中,会形成酸雨的是( )
A . N2
B . O2
C . SO2
D . CO2
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时,SO2会部分转化为SO3 , 使空气的酸度增加。飘尘所起的作用可能是( )
A . 氧化剂
B . 还原剂
C . 催化剂
D . 吸附剂
一定物质的量的SO2与氢氧化钠溶液反应,所得溶液中除含Na2SO3外,同时也含NaHSO3 , 并且两者的物质的量之比为2:3,则参加反应的SO2与NaOH物质的量之比为( )
A . 5:7
B . 7:5
C . 8:11
D . 11:8
(NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A . 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1
B . 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2
C . 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3
D . 从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图,下列说法错误的是( )
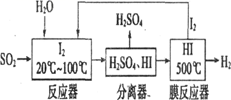
A . 该工艺中I2和HI的相互转化体现了“碘循环”
B . 反应器中,控制温度为20-100℃,温度过低速率慢,温度过高水气化且增大碘的流失,反应速率也慢
C . 分离器中的物质分离操作为过滤
D . 碘循环工艺的总反应为SO2+2H2O=H2+H2SO4
某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是( )
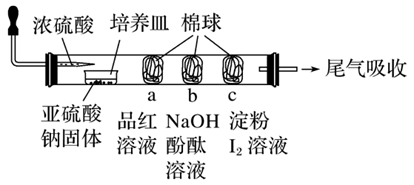
A . a棉球褪色,验证SO2具有氧化性
B . c棉球蓝色褪去,验证SO2氧化性
C . b棉球褪色,验证SO2具有酸性氧化物的性质
D . 可以使用浓硫酸吸收尾气
最近更新



