工业制取硫酸 知识点题库
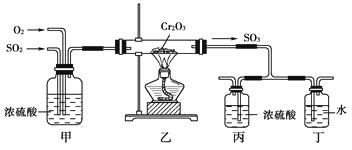
试填写下列空白:
-
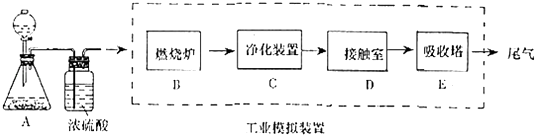
(1) 写出工业上用FeS2制取SO2的化学方程式:。
-
(2) 写出上图中部分装置的作用:①甲;
②丙和丁:。
-
(3) 若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸中的导管插入太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾:②。
-
(4) 上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于;丙和丁相当于。
-
(5) 在硫酸工业制法中,下列对生产操作与说明生产操作的主要原因的叙述都正确的是________(填下列选项的序号)。A . 硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧 B . 从沸腾炉出来的炉气需净化,因为炉气中二氧化碳会与杂质反应 C . 二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 D . 三氧化硫用98.3%的浓硫酸溶液吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )

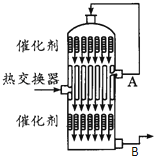
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如图).按此密闭体系中气体的流向,B处流出的气体主要为( )
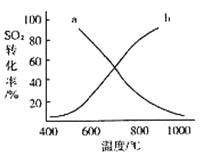
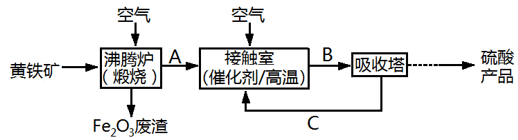
工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:
(1)煅烧黄铁矿的设备名称是 ,进料前必须将黄铁矿粉碎,目的是 (填一种用途).
(2)进入接触室前的气体必须经过净化处理,目的是防止 .
(3)生产过程中,吸收三氧化硫常用的物质是 .
(4)温度变化与二氧化硫转化率的变化关系可用如图中的曲线 (填“a”或“b”)表示.
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体.反应的化学方程式为: 、 .
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 .
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体.
①导致溶液温度降低的原因可能是 ;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产.已知该结晶水合物的相对分子质量为134,则其化学式为 ;
③生产中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 .
(3)能用于测定硫酸尾气中SO2含量的是 .(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.水、淀粉溶液
D.氨水、酚酞试液.
以黄铁矿为原料生产硫酸的工艺流程图如下:
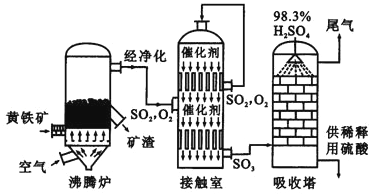
(1)将燃烧黄铁矿的化学方程式补充完整:4 +11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 .
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) .
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是 .
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2 . SO2吸收Br2的离子方程式是 .
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变.计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 .(计算结果保留两位小数)
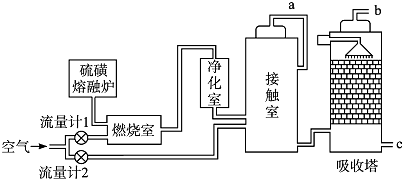
-
(1) 装置A用来制取氧气,写出相应的化学方程式;
-
(2) 燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为
4FeS2+11O2
 2Fe2O3+8SO2 , 在该反应中做氧化剂,若消耗了12gFeS2有 mol电子发生了转移;
2Fe2O3+8SO2 , 在该反应中做氧化剂,若消耗了12gFeS2有 mol电子发生了转移; -
(3) C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是;
-
(4) 如果D装置的温度是400℃~500℃,在常压下生成0.1molSO3 , 可放出9.83kJ的热量,请写出该反应的热化学方程式,并回答在工业中不采取加压措施的原因;
-
(5) 为检验从接触室出来的气体成分,甲同学设计如下实验:
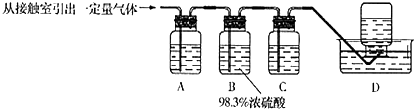
①A中盛放的试剂是;
②B中盛放98.3%浓硫酸的作用是,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案(填“可行”或“不可行”),说明理由;
③C中盛放的试剂是,其作用是.
请回答下列问题:
-
(1) 为充分利用反应放出的热量,接触室中应安装(填设备名称);吸收塔中填充有许多瓷管,其作用是;吸收塔不用水而用98.3%浓硫酸吸收SO3的原因是.
-
(2) 硫酸的用途非常广泛,可应用于下列哪些方面.
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.制备大量硫磺
-
(3) 硫酸的各个生产环节中都有一些废渣、废液、废气产生,需要进行治理.由吸收塔排出的尾气中SO2的含量若超过500 μL•L﹣1 , 就要加以处理处理才能排出.处理方法之一是用氨水洗涤烟气脱硫,所得产物可作为肥料.请写出此脱硫过程中可能发生的化学方程式:.
-
(4) 用含硫量为a%硫矿制硫酸,若燃烧时损失b%的硫元素,由SO2制SO3的转化率为c%.则制取1吨98%的硫酸需这种硫矿吨(用代数式表达)
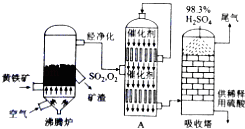
-
(1) 硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为.
-
(2) 流程图中设备A是(填设备名称),其中该设备上部迅婚使用的气体为.
-
(3) 吸收塔采用98.3%浓硫酸吸收SO2的原因是.
-
(4) 根据工艺流程图及环保角度判断下列说法正确的是 (填序号)A . 为使黄铁矿充分燃烧,需将其粉碎 B . 沸腾炉中排出的炉渣可供炼铁 C . 使用催化剂可提高SO2的反应速率和转化率 D . 尾气中SO2可用NaOH浓溶液来吸收 E . 硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
-
(5) 沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
600
620
640
660
炉渣中CuSO4的质量分数/%
9.3
9.2
9.0
8.4
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因.
-
(6) 某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为.
 B . 由重晶石制可溶性钡盐:重晶石(BaSO4)
B . 由重晶石制可溶性钡盐:重晶石(BaSO4)  BaCO3
BaCO3  BaCl2(aq)
C . 由石英砂制高纯硅:石英砂
BaCl2(aq)
C . 由石英砂制高纯硅:石英砂  粗硅
粗硅 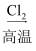 SiCl4
SiCl4  Si
D . 由铝土矿冶炼铝:铝土矿
Si
D . 由铝土矿冶炼铝:铝土矿  Al2O3
Al2O3 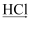 AlCl3(aq)
AlCl3(aq)  Al
Al
回答下列问题:
-
(1) 在接触室中发生的反应是2SO2+O2
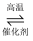 2SO3 , 该反应属于(填字母)
2SO3 , 该反应属于(填字母) a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
-
(2) 写出Cu和浓硫酸反应的化学方程式。
-
(3) 写出沸腾炉中发生反应的化学方程式:
-
(4) 取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是。
-
(5) SO2可用于杀菌、消毒。葡萄酒里含有微量SO2 , 起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的还原性。氯水和SO2都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:。
| 选项 | 化学工业 | 措施 | 目的 |
| A | 合成氨 | 500℃左右 | 防止催化剂中毒 |
| B | 石油化工 | 裂化 | 提高轻质油的产量 |
| C | 工业制硫酸 | V2O5催化 | 提高SO2的转化率 |
| D | 侯氏制碱 | 先通CO2 | 有利于CO2充分吸收 |
途径①: 
途径②: 
途径③: 
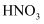 的强氧化性
B . 途径②、③的第二步反应在实际生产中可以通过增大
的强氧化性
B . 途径②、③的第二步反应在实际生产中可以通过增大  的浓度来降低成本
C . 由途径①、②、③分别制取
的浓度来降低成本
C . 由途径①、②、③分别制取 
 ,理论上各消耗
,理论上各消耗  S,各转移
S,各转移 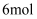
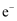 D . 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理念
D . 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理念
 氧化为
氧化为  时需使用催化剂,这样是为了提高
时需使用催化剂,这样是为了提高  的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥
的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥



