氮的固定 知识点题库
(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
反应 | 大气固氮 N2(g)+O2(g)⇌2NO(g) | 工业固氮 N2(g)+3H2(g)⇌2NH3(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于 (填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因 .
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 .
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是 (填“A”或“B”);比较р1、р2的大小关系 .

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是 .
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g),则其反应热△H= .
(已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1 , 2H2(g)+O2(g)⇌2H2O(l)△H=﹣571.6kJ•mol﹣1)
氮是大气中含量最多的一种元素,氮及其化合物在生产、生活中有着重要作用.请回答:
(1)下列变化属于“氮的固定”的是 (填字母)
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)据报道,意大利科学家获得了极具研究价值的N4 , 其分子结构如图1所示.
已知Ⅰ.断裂1mol N﹣N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,
Ⅱ.N2 (g)+3H2(g)2NH3(g)△H=﹣92.2kJ•mol﹣1则:N4 (g)+6H2 (g)4NH3(g)△H= kJ•mol﹣1
(3)图2是工业生产硝酸的流程.
①1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:

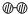 、
、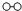 、
、 分别表示N2、H2、NH3 . 图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 .
分别表示N2、H2、NH3 . 图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 .
②合成塔中发生反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.2kJ•mol﹣1 , 该反应的化学平衡常数表达式K= .在一定温度和压强下,将H2和N2按3:1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为 .
③吸收塔中通入空气的目的是 .
(1)下列过程没有起到氮的固定作用的是 (填选项).
A.N2与O2反应生成NO B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物
(2)实验室里可以选择下列实验装置中的 (填选项)制取氨气.
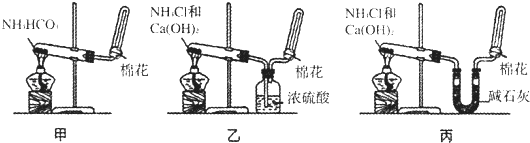
写出实验室制取氨气的化学方程式 ,检验氨气是否收集满的方法除用湿润的红色石蕊试纸以外还可以用 .
II.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
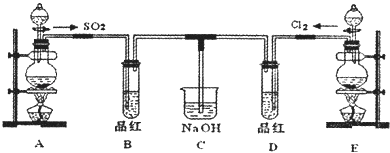
(1)实验中用装置E制备Cl2 , 该反应的化学方程式为: ;若有6mol的HCl参加反应,则转移的电子的物质的量为 .
(2)①反应开始一段时间后,观察到B、D两个试管中的晶红溶液出现的现象分别是:B ,D .
②停止通气后,再将B、D两个试管分别加热,两个试管中的现象分别是:
B ,D .
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定 会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请结合离子方程式说明产生该现象的原因:
.
选项 | 古文或谚语 | 化学解释 |
A | 日照香炉生紫烟 | 碘的升华 |
B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
C | 煮豆燃豆萁 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
 B . 其溶液呈酸性的原因:NH4Cl + H2O ⇌ NH3·H2O +HCl
C . 工业上“氮的固定”:NH3 + HCl = NH4Cl
D . 比较微粒半径:N>Cl->H
B . 其溶液呈酸性的原因:NH4Cl + H2O ⇌ NH3·H2O +HCl
C . 工业上“氮的固定”:NH3 + HCl = NH4Cl
D . 比较微粒半径:N>Cl->H
| 选项 | 传统文化 | 化学角度解读 |
| A | 兰陵美酒郁金香,玉碗盛来琥珀光 | “香”主要因为美酒含有酯类物质 |
| B | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe2O3 |
| C | 三月打雷麦谷堆 | 在雷电作用下N2转化成能被作物吸收的氮元素 |
| D | 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也 | 利用物理方法(焰色反应)可以检验钠盐和钾盐 |
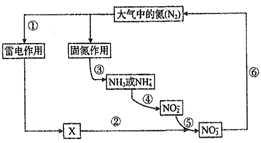
 2NO
B . 过程③“固氮作用”中,氮气被还原
C . 过程⑤中涉及的反应可能有2NO
2NO
B . 过程③“固氮作用”中,氮气被还原
C . 过程⑤中涉及的反应可能有2NO  +O2=2NO
+O2=2NO  D . 过程⑥中涉及的反应可能有2NO
D . 过程⑥中涉及的反应可能有2NO  +12H+=N2↑+6H2O
+12H+=N2↑+6H2O
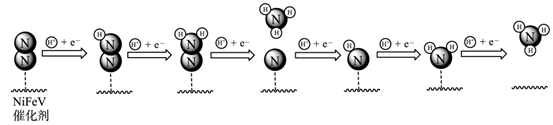
 表面催化氮气固定机理如图所示,下列叙述错误的是( )
表面催化氮气固定机理如图所示,下列叙述错误的是( ) 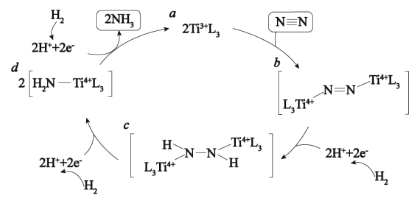
 C . 整个催化过程中存在
C . 整个催化过程中存在 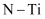 键的断裂和生成
D . 催化剂可以提高固氮速率的原因是改变该反应的△H
键的断裂和生成
D . 催化剂可以提高固氮速率的原因是改变该反应的△H

 ,
,  均属于氮的固定
B . 硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C .
均属于氮的固定
B . 硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C .  很稳定,不支持任何物质的燃烧
D . 所有的铵盐受热分解都会产生
很稳定,不支持任何物质的燃烧
D . 所有的铵盐受热分解都会产生 

-
(1) 如图所示氮循环中,属于氮的固定的有(填字母序号)。
a.
 转化为铵态氮 b.硝化过程 c.反硝化过程
转化为铵态氮 b.硝化过程 c.反硝化过程 -
(2) 氮肥是水体中铵态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为。
②检验铵态氮肥中
 的实验方案是。
的实验方案是。 -
(3) 铵态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为mol。
-
(4) 常温下氨气能被氯气氧化生成
 ,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。
,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。 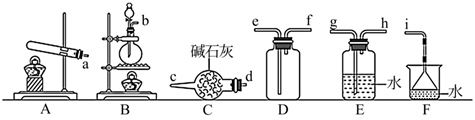
Ⅰ.氨气的制备。欲制备和收集一瓶干燥的氨气可以选择图中的装置(填大写字母)。
Ⅱ.氯气与氨气的反应(已知:实验前
 、
、  关闭)。
关闭)。
①打开
 ,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭
,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭  ,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。
,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。②再打开
 ,可观察到的现象是。
,可观察到的现象是。



