亚硝酸盐 知识点题库
试回答下列问题:
-
(1) 下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
-
(2) Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是 (填序号).
A.Cl2 B.Fe C.H2O2 D.HNO3
-
(3) 某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3﹣和Mn2+ , 请写出反应的离子方程式:
-
(4) 已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是
-
(1) 美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 .(选填编号)
a.解毒时美蓝表现氧化性b.中毒时亚硝酸盐发生氧化反应
c.解毒时高铁血红蛋白被还原d.中毒过程中血红蛋白显氧化性
-
(2) NaNO2中钠离子核外有 种不同能级的电子,三种元素对应的简单离子半径由大到小的顺序为
-
(3) Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因
-
(4) 已知NaNO2能发生如下反应(未配平):NaNO2+HI→NO+I2+NaI+H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是 L.
-
(5) 有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107Pa,然后加热至50℃时,发现气体的压力迅速下降.当温度恢复到常温,压强降至略小于1.01×107Pa的
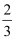 时,就不再改变.已知此过程中有一种产物是N2O.请写出生成N2O的反应方程式: .解释最后的气体压强略小于1.01×107Pa的
时,就不再改变.已知此过程中有一种产物是N2O.请写出生成N2O的反应方程式: .解释最后的气体压强略小于1.01×107Pa的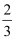 原因:
原因:
-
(6) 某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②NH4Cl、③HNO3、④浓H2SO4 , 能使NaNO2转化为N2的是 .(选填编号)
-
(1) 上述反应中氧化剂是
-
(2) 根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水、②淀粉碘化钾试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有 (填序号).
-
(3) 某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4 .
-
(1) 下列试剂可鉴别工业盐和食盐的是.
a.H2O b.酸性高锰酸钾溶液 c.盐酸
-
(2) NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为.
-
(3) 某工厂废液中含有2%﹣5%的NaNO2 , 直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是.
a.NaCl b.NH4Cl c.浓H2SO4
-
(4) 氯碱工业通过电解饱和食盐水来获得相应的产物.请写出电解食盐水的离子方程式.
-
(1) 若有1.5mol的NaNO2参加反应,被氧化的HI是 mol.
-
(2) 根据上述反应,可以用试纸和生活中常见的物质进行试验,以鉴别NaNO2和NaCl,可选的物质有:
①自来水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒.
进行实验时,选用的物质或试纸是(填序号)
-
(3) 某厂废切削液中含2%﹣5%的NaNO2 , 直接排放会造成污染,下列试剂(填序号)能使NaNO2转化为不引起二次污染的N2 .
①NaCl ②NH4Cl ③KMnO4④浓硝酸
反应的化学方程式为.
试回答下列问题:
-
(1) 人体正常的血红蛋白中含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).A . 亚硝酸盐是还原剂 B . 维生素C是还原剂 C . 维生素C将Fe3+还原为Fe2+ D . 亚硝酸盐被还原
-
(2) 下列方法中,不能用来区别NaNO2和NaCl的是 (填序号).A . 测定这两种溶液的pH B . 用AgNO3和HNO3两种试剂来区别 C . 在酸性条件下加入KI淀粉溶液来区别 D . 分别在两种溶液中滴加甲基橙
-
(3) 某同学把新制氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出此反应的离子方程式:.
-
(4) 为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:KMnO4溶液在滴定过程中作(填“氧化剂”或“还原剂”),该滴定过程(填“需要”或“不需要”)另加指示剂.
-
(5) 已知HNO2的酸性比醋酸略弱,某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由(若能请结合化学方程式并用适当的文字说明).
-
(1) 上述反应的氧化剂是
-
(2) 根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有(填序号).
-
(3) 某厂废切削液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2是 (填字母编号).A . NaCl B . NH4Cl C . HNO3 D . 浓H2SO4
-
(4) 饮用水中的NO3对人类健康会产生危害.为了降低饮用水中NO3的浓度,某饮用水研究人员指出,在碱性条件下用铝粉将NO3﹣还原为N2 , 请配平如下所示的化学方程式:
Al+NaNO3+NaOH═ NaAlO2+N2↑+H2O
若反应过程中转移5mol e﹣ , 则生成标准状况下N2的体积为 L.
-
(1) NaNO2 中 N 元素的化合价为.
-
(2) 亚硝酸钠在 320℃ 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式。
-
(3) 我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠千克。
-
(4) 在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为(填化学式)。
-
(5) 工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为。
-
(6) 某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数
1
2
3
4
消耗KMnO4溶液体积/mL
20.70
20.02
20.00
19.98
该样品中亚硝酸钠的质量分数为.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
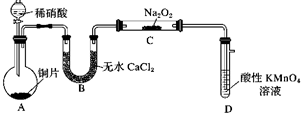
| 选项 | A | B | C | D |
| 目的 | 验证锌与硫酸铜反应过程中有电子转移 | 探究亚硝酸钠的氧化性 | 实验室制备乙酸乙酯 | 实验室制备氨气 |
| 实验方案 | | | | |
(一)查阅资料
①亚硝酸钠(NaNO2)为无色、无味的晶体。
②HNO2是一种弱酸,能被常见强氧化剂氧化,但又是一种氧化剂,如把Fe2+氧化为Fe3+。
(二)问题讨论
-
(1) 人体正常的血红蛋白中应含Fe2+ , 误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,若发生中毒时,你认为下列物质有助于解毒的是_______。A . 鸡蛋清 B . 胃舒平[主要成分是Al(OH)3] C . 小苏打 D . 维生素C
-
(2) 亚硝酸钠和食盐性状相似,可采用碘化钾淀粉溶液(用稀硫酸酸化)来鉴别NaNO2和NaCl,证明是NaNO2的实验现象是,请解释稀硫酸的作用是。
-
(3) (三)实验测定
为了测定某样品中NaNO2的含量,进行如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形瓶中,用
 KMnO4 , 标准溶液进行滴定(还原产物为Mn2+),滴定结束后消耗KMnO4溶液VmL。
KMnO4 , 标准溶液进行滴定(还原产物为Mn2+),滴定结束后消耗KMnO4溶液VmL。上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有(填一种)。
-
(4) 用KMnO4标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→→→→→→开始滴定
A.用KMnO4标准溶液润洗2至3次
B.记录起始读数
C.调整滴定液液面至零刻度或零刻度以下
D.排除气泡
E.装入滴定液至碱式滴定管零刻度以上
F.装入滴定液至酸式滴定管零刻度以上
G.用NaNO2溶液润洗2至3次
-
(5) 计算该样品中NaNO2的质量分数为(用含字母a、V的最简式表示)。
 可用于自来水消毒
B .
可用于自来水消毒
B . 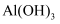 可用作治疗胃酸过多的药物
C .
可用作治疗胃酸过多的药物
C .  不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
选项 | 实验 | 现象 | 结论 |
A | 向 | 产生白色沉淀,且有无色气体生成 | 溶液中 |
B | 检验某无色溶液中是否含有 | 溶液变黄色且试管上部产生红棕色气体 | 该溶液中含有 |
C | 将铜粉放入稀硫酸溶液中并不断通入 | 铜粉快速溶解,溶液变为蓝色 | 形成 |
D | 向某钾盐中滴加浓盐酸,产生的气体再通入品红溶液 | 品红溶液褪色 | 该钾盐为 |
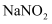 , 外观和食盐相似,有咸味,人们曾多次发生过因误食
, 外观和食盐相似,有咸味,人们曾多次发生过因误食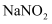 而中毒的事件,其原因是
而中毒的事件,其原因是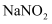 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力。金属加工后的废液中含有2%~5%的
结合的能力。金属加工后的废液中含有2%~5%的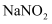 , 它是一种环境污染物,人们用
, 它是一种环境污染物,人们用 溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:第一步:
第二步:
以下说法错误的是( )
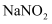 体现氧化性
B . 工业盐中毒后,可服用维生素C(维生素C具有还原性)来缓解中毒
C . 工厂废液处理过程中的反应均为氧化还原反应
D . 工厂废液处理过程中第二步中的
体现氧化性
B . 工业盐中毒后,可服用维生素C(维生素C具有还原性)来缓解中毒
C . 工厂废液处理过程中的反应均为氧化还原反应
D . 工厂废液处理过程中第二步中的 既被氧化又被还原
既被氧化又被还原



 溶液中滴入
溶液中滴入 溶液
溶液 部分电离出
部分电离出 和
和 ,
,  与
与 沉淀,促进了
沉淀,促进了 的电离,使
的电离,使
 , 取少量该溶液于试管中,加稀盐酸酸化,再加入
, 取少量该溶液于试管中,加稀盐酸酸化,再加入 溶液
溶液 溶液
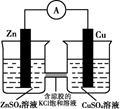
溶液 原电池,加快反应速率
原电池,加快反应速率 或
或 或者二者混合物
或者二者混合物


