亚硝酸盐 知识点题库
下列物质误食后不会引起中毒的是 ( )
A . 味精
B . NaNO2
C . CH3OH
D . 白磷
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2 . 下列有关说法错误的是( )
A . NaNO2既具有氧化性又具有还原性
B . 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C . NaNO2和胃酸作用的离子方程式为:2NO2﹣+2H+═NO↑+NO2↑+H2O
D . 1 mol NaNO2在酸性条件下完全反应生成NO和NO2 , 转移电子的物质的量为1 mol
下列说法中不正确的是( )
A . 亚硝酸钠不但是防腐剂,而且还有抗氧化作用
B . 污水处理可采用混凝法,明矾是一种常用的混凝剂
C . 加碘食盐中加入的是碘单质
D . 肉蛋类等富含蛋白质的食物多为酸性食物
NaNO2有像食盐一样的外观和咸味,它对人体的毒性表现为:可将正常的血红蛋白变为高铁血红蛋白(使血红蛋白中的铁元素由二价变为三价),失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂.下列有关NaNO2毒性分析正确的是( )
A . 因解毒剂美蓝具有氧化性
B . 中毒时亚硝酸盐发生氧化反应
C . 解毒时高铁血红蛋白被还原
D . 中毒时血红蛋白分子被还原
亚硝酸钠又称为“工业盐”,下列关于亚硝酸钠的叙述不正确的是( )
A . 亚硝酸钠外观与食盐相似,亚硝酸钠和食盐一样也具有咸味
B . 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂
C . 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀
D . 某钠盐溶液中可能含有SO42﹣、SO32﹣、CO32﹣、NO2﹣ , 加足量BaCl2溶液,产生白色沉淀,再加稀硝酸沉淀溶解且放出有色刺激性气体,该溶液中肯定有NO2﹣肯定没有SO42﹣、SO32﹣
在食品工业或餐饮业中使用量特别要注意严加控制的物质是( )
A . 氯化钠
B . 谷氨酸钠
C . 蔗糖
D . 亚硝酸钠
越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟.一些“毒奶粉”竟然顶着国家“免检产品”桂冠.某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
-
(1) 上述反应中氧化剂是 ,若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
-
(2) 根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒.进行实验时,必须选用的物质有 .(填编号)
-
(3) 某厂废切削液中,含2%~5%的NaNO2 , 直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2 . (填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为
食盐和工业用盐具有广泛的用途.已知,工业盐含NaNO2 , 外观酷似食盐并有咸味.NaNO2有氧化性和还原性,遇酸分解放出NO2 .
-
(1) 下列试剂可鉴别工业盐和食盐的是 .
a.H2O b.酸性高锰酸钾溶液 c.盐酸
-
(2) NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为
-
(3) 某工厂废液中含有2%﹣5%的NaNO2 , 直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是 .
a.NaCl b.NH4Cl c.浓H2SO4
-
(4) 氯碱工业通过电解饱和食盐水来获得相应的产物.请写出电解食盐水的离子方程式
硝酸盐可用作化肥、军用炸药、杀虫剂、冷冻剂等,工业制取硝酸钱的工艺流程如图1:
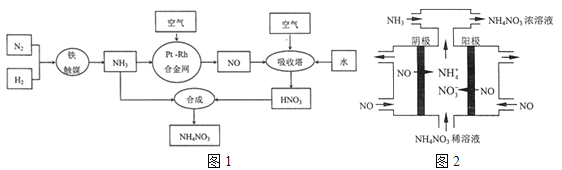
-
(1) 合成氨气的工业设备名称是 ,设备中设置热交换器的目的是 ,合成氨的原料气必须先脱硫,目的是
-
(2) 吸收塔中反应的化学方程式为 从生产流程看,吸收塔中需要补充空气,其原因是
-
(3) 生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH=2NaNO2+H2O;
2NO2+N2CO3=NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=﹣2635kJ.mol﹣1(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2(g)═CO2(g)+N2(g)+2H2O(g)△H=+867kJ.mol﹣1(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是
方法三和方法二相比,方法三的缺点是
-
(4) 工业上也可以通过电解NO制备NH4NO3 , 其工作原理如图2所示.
①图中通入NH3的目的是
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为 g.(已知F=96500C•mol一l)
-
(5) 某化肥厂用NH3制备NH4NO3 . 已知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH=2NaNO2+H2O。工艺流程如下

-
(1) 分解塔中填有大量的瓷环,其目的是:。
-
(2) 按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: 。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为。
-
(3) 通入一定量的N2的目的是: 。
-
(4) 吸收塔中尾气如何再利用:。
最近更新



