含有氢键的物质 知识点
含有氢键的物质 :常见含氢键物质有水、氨水、氢氟酸、乙醇、甲醇、乙酸等含有N、或O或 F、和氢的物质。氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y接近,在X与Y之间以氢为媒介,生成的一种特殊的分子间或分子内相互作用,称为氢键。X与Y可以是同一种类分子,如水分子之间的氢键;也可以是不同种类分子,如一水合氨分子之间的氢键。
含有氢键的物质 知识点题库
下列说法中不正确的是( )
A . 所有含氢元素的化合物中都存在氢键,氢键是一种类似于共价键的化学键
B . 离子键、氢键、范德华力本质上都是静电作用
C . 只有电负性很强、半径很小的原子(如F、O、N)才能形成氢键
D . 氢键是一种分子间作用力,氢键比范德华力强
下列每组分子主要能形成分子间氢键的是( )
A . HClO4和 H2SO4
B . CH3COOH和H2Se
C . C2H5OH和NaOH
D . H2O2和HNO3
你认为下列说法正确的是( )
A . 含有N、O、F的分子和含有氢原子的分子间一定存在氢键
B . 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大
C . 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子
D . 过氧化氢气化时肯定只破坏分子间作用力和氢键
(1)解释冰为什么浮在水面上(从结构的角度予以解释)
(2)在苯甲酸的重结晶实验中,滤液放置冷却可以结晶出纯净的苯甲酸晶体,温度越低苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时温度越低越好?
下列六种有机物:①2﹣甲基丁烷 ②2,2﹣二甲基丙烷 ③丙烷 ④戊烷 ⑤2﹣甲基丙烷 ⑥乙醇,按它们的沸点由高到低的顺序排列为( )
A . ①②③④⑤⑥
B . ②③④⑤⑥①
C . ④⑤⑥②①③
D . ⑥④①②⑤③
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
-
(1) 工业制硫酸中SO2转化为SO3的催化剂常用V2O5 .
①写出V的基态价电子排布式.
②反应物SO2分子中S原子的杂化轨道类型为.
③将催化剂V2O5加入到NaOH溶液中,可生成Na3VO4 , 该盐阴离子的立体构型为
-
(2) 高温陶瓷材料Si3N4晶体中键角N﹣Si﹣NSi﹣N﹣Si(填“>”“<”或“=”),原因是
-
(3) 硼酸(H3BO3)为白色粉末状晶体,分子中非羟基氧原子数为0,则其结构式为.
-
(4) 下列物质的结构或性质与氢键有关的是.
a.常温常压下H2S、H2Se、H2Te都是气体,只有水以液态存在
b.DNA的双螺旋结构较稳定
c.乙醚(CH3CH2﹣O﹣CH2CH3)易挥发
d.乙醇与水以任意比互溶
-
(5) 储氢材料镧镍合金晶胞结构如图所示:已知镧镍合金LaNin晶胞体积为8.5×10﹣23cm3 , 储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=(填数值);氢在合金中的密度为(保留两位有效数字).

氟化氢水溶液中存在的氢键有种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为,1个分子中含有个π键。
下列化学用语表示错误的是( )
A . 氮原子价层电子的轨道表示式: 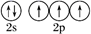 B . 乙腈(CH3CN)的结构式:CH3-C≡N
C . HF分子间氢键示意图:
B . 乙腈(CH3CN)的结构式:CH3-C≡N
C . HF分子间氢键示意图: 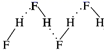 D . Cu2+基态核外电子排布式:1s22s22p63s23p63d9
D . Cu2+基态核外电子排布式:1s22s22p63s23p63d9
 D . Cu2+基态核外电子排布式:1s22s22p63s23p63d9
D . Cu2+基态核外电子排布式:1s22s22p63s23p63d9
下列物质①乙烷 ②丙烷 ③乙醇,沸点由高到低的顺序正确的是( )
A . ①>②>③
B . ②>①>③
C . ③>②>①
D . ③>①>②
关于氢键,下列说法正确的是( )
A . 含氢元素的化合物中一定存在氢键
B . 氢键比范德华力强,所以它属于化学键
C . DNA中的碱基互补配对是通过氢键来实现的
D . H2O是一种非常稳定的化合物,这是由于氢键所致
下列化合物中,分子间不存在氢键的是( )
A . NH3
B . H2O
C . HNO3
D . HBr
Cu2O溶于硫酸生成Cu和CuSO4 , CuSO4溶液中加入强碱产生蓝色絮状沉淀,继续加入强碱沉淀溶解生成蓝色[Cu(OH)4]2-。CuSO4·5H2O的晶体结构如图,关于铜的化合物说法错误的是( )
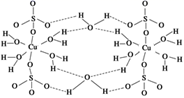
A . 蛋白质溶液中加入CuSO4发生盐析
B . Cu2O溶于硫酸的离子方程式:Cu2O+2H+=Cu2++Cu+H2O
C . Cu(OH)2为两性氢氧化物,可用于鉴别葡萄糖和蔗糖
D . CuSO4·5H2O晶体中  与水分子之间存在氢键
与水分子之间存在氢键
 与水分子之间存在氢键
与水分子之间存在氢键
下列说法正确的是( )
A . 纯碱和烧碱熔化时克服的化学键类型相同
B . HF在高温下也不容易分解,是因为HF分子之间存在氢键
C . SiO2和CO2熔点相差很大,是因为Si-O的键能比C=O的键能大
D . 在HCl分子中,各原子最外电子层都形成了具有8个电子的稳定结构
关于氢键,下列说法正确的是( )
A . 分子中有N、O、F原子,分子间就存在氢键
B . 因为氢键的缘故, 比
比 熔、沸点高
C . 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D . “可燃冰”——烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
熔、沸点高
C . 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D . “可燃冰”——烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
 比
比 熔、沸点高
C . 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D . “可燃冰”——烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
熔、沸点高
C . 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D . “可燃冰”——烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
青藏铁路沿线的路基两旁插有一排排热棒,其内部为装有液氨的密闭空心长棒。在冬季,土中的热量使液氨蒸发到顶部,冷却后又液化回到下部,保持冻土冷冻状态不松软。下列说法正确的是( )

A . 液氨蒸发时破坏了分子间的氢键和共价键
B . NH3的中心原子采用sp3杂化
C . NH3是含有极性键的极性分子
D . 沸点:NH3>PH3
X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1 , X与W为同主族元素。基态R原子的M电子层全充满,核外有且仅有1个未成对电子。请回答下列问题:
-
(1) 基态R原子核外价电子排布式为。
-
(2) X、Y、Z三种元素的第一电离能由大到小的顺序为(填元素符号)。
-
(3) 元素Y的简单气态氢化物的沸点 (填“高于"或“低于")元素X的简单气态氢化物的沸点,其主要原因是 元素Y的简单气态氢化物中Y原子的杂化类型为,元素X的简单气态氢化物分子的空间结构为。
-
(4) Y的简单气态氢化物在水中可形成氢键,其氢键最可能的形式为 ____ (填序号)。A .
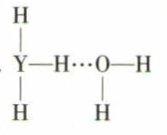 B .
B . 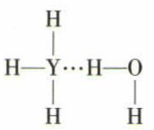 C .
C . 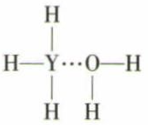 D .
D . 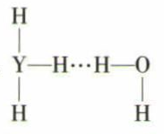
-
(5) 分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,X的最高价氧化物分子中的大π键应表示为,其中σ键与π键的数目之比为。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,X的最高价氧化物分子中的大π键应表示为,其中σ键与π键的数目之比为。
-
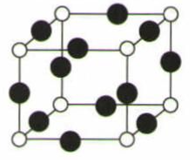
(6) R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子) ,若该晶胞的边长是acm,则该晶体的密度为g·cm-3(用NA表示阿伏加德罗常数的值)。
某有机物的结构简式如图。下列有关该有机物的说法不正确的是( )
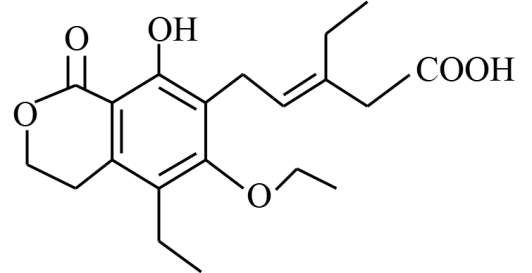
A . 分子式为C20H26O6
B . 既可以形成分子内氢键又可以形成分子间氢键
C . 分子中有一个手性碳原子,具有一定的光学活性
D . 1mol该有机物最多与3molNaOH反应
下列说法中错误的是( )
A . 水汽化过程中破坏了氢键和共价键
B . 酸性强弱:甲酸>乙酸>丙酸
C . 基态碳原子核外有三种能量不同的电子
D . 用X射线衍射实验可鉴别食盐是否为晶体
离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1-乙基-3-甲基咪唑四氟硼酸盐离子液体结构如图所示,其环状结构中存在大π键,下列相关叙述错误的是( )
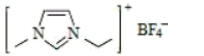
A . 该物质阳离子中至少10原子共平面
B . 该物质阴离子呈正四面体形
C . 该离子液体存在共价键、配位键、氢键
D . 该离子液体与水能够形成氢键
下列说法错误的是( )
A . 将水加热变为气态,主要破坏范德华力
B . HF的溶液中存在4种类型的氢键
C . 依据NH3•H2O NH
NH +OH-可知NH3•H2O的合理结构式为
+OH-可知NH3•H2O的合理结构式为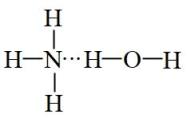 D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色
D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色
 NH
NH +OH-可知NH3•H2O的合理结构式为
+OH-可知NH3•H2O的合理结构式为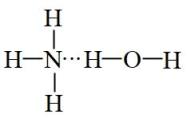 D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色
D . 形成配位键的金属离子通常是过渡金属离子,许多金属配合物有鲜艳的颜色
最近更新



