氢键的存在对物质性质的影响 知识点题库
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含极性键或非极性键
③非极性键既可能存在于单质和共价化合物中,也可能存在于离子化合物中
④离子化合物在融化时破坏离子键,共价化合物在融化时只破坏范德华力
⑤冰可以浮在水面上以及乙醇能够跟水任意比互溶都跟氢键有关
⑥氮的非金属性比磷的强,且分子间作用力较小,所以氮气比磷活泼
⑦虽然燃料电池的能量转化率理论上是100%,但实际上只达到40%﹣60%
⑧无论吸热反应还是放热反应,升高温度,就一定可以使反应速率加快
⑨化学键可分为离子键、共价键和氢键
⑩在原电池内部,阴离子向负极移动,阳离子向正极移动.
-
(1) C、N、O元素的第一电离能大小为:。
-
(2) Cu的价电子排布式为,基态Fe原子有个未成对电子,Fe3+的价电子排布图为。
-
(3) 基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为。硫的一种同素异形体分子式为S8 , 其结构如图所示,其中S原子的杂化轨道类型为。S8易溶于二硫化碳的原因是。

-
(4) 教材插图具有简洁而又内涵丰富的特点。请回答以下问题:

(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有种不同运动状态的电子。
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于晶体。
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是。判断依据。
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键的键角是109°28′ |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且分子间存在氢键影响 |
| D | HF的沸点高于HCl | H-F的键长比H-Cl的短 |
-
(1) 能表示能量最低的亚铁离子的电子排布式是(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
-
(2) 琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是,碳原子的杂化方式是;琥珀酸亚铁中存在配位键,在该配位键中配位原子是,中心原子是。
-
(3) 富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称
Ka1
Ka2
富马酸(
 )
)7.94×10-4
2.51×10-5
马来酸(
 )
)1.23×10-2
4.68×10-7
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:。
-
(4) β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有种空间取向,晶胞体内硫酸根离子的个数是,铁原子周围最近的氧原子的个数为;设阿伏加德罗常数的值为NA , 则该晶体的密度是g·cm-3(列出计算表达式)。

①离子化合物中一定有离子键,一定没有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③共价化合物中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
 并获得了该化合物的LED器件。
并获得了该化合物的LED器件。 
-
(1) 基态O原子能量最高的电子,其电子云在空间有个延展方向;C原子的基态电子排布式为;
-
(2) NO3-与
 互为等电子体,构型为;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为、。
互为等电子体,构型为;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为、。 
-
(3)
 可用
可用 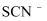 检验,其对应的酸有两种,分别为硫氰酸(H−S−C≡N)和异硫氰酸(H−N=C=S),这两种酸中沸点较高的是,试分析原因:;热稳定性:
检验,其对应的酸有两种,分别为硫氰酸(H−S−C≡N)和异硫氰酸(H−N=C=S),这两种酸中沸点较高的是,试分析原因:;热稳定性:  (填“<”“>”或“=”)
(填“<”“>”或“=”) 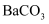 。
。
-
(4) 超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为
 ,As原子到B原子最近距离为(用含a的式子表示),该晶体的密度是g.cm-3 (列出含a、
,As原子到B原子最近距离为(用含a的式子表示),该晶体的密度是g.cm-3 (列出含a、  的计算式即可)。
的计算式即可)。
-
(1) I下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
k的基态原子核外有个未成对电子。
-
(2) c、d、e三元素形成的X、Y两种物质的分子结构和部分物理性质如下表,两者熔沸点差异的主要原因是。
代号
结构简式
水中溶解度/g(25℃)
熔点/℃
沸点/℃
X

0.2
45
100
Y

1.7
114
295
-
(3) o、p两元素的部分电离能数据列于下表:
元素
o
p
电离能/(kJ·mol-1)
I1
717
759
I2
1509
1561
I3
3248
2957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。原因是。
-
(4) II铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是。FeSO4常作补铁剂,
 的立体构型是。
的立体构型是。 -
(5) 羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含molσ键,与CO互为等电子体的离子是(填化学式,写一种)。
-
(6) 氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为。

-
(7) 氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为;Fe2+与O2-最短核间距为pm。(列出计算式即可)。
 。
。
请回答:
-
(1) Q 在元素周期表中的位置: 。
-
(2) Y的最高价氧化物的水化物中存在的化学键类型: 。
-
(3) X的简单氢化物比 W 的简单氢化物熔沸点高的原因: 。
-
(4) Z与Q两者的最高价氧化物对应的水化物反应的离子方程式: 。
-
(5) Y的氢化物可由单质化合而成,请用电子式表示该氢化物形成过程: 。
化合物(相对分子质量) | 沸点/℃ | 化合物(相对分子质量) | 沸点/℃ |
甲醇(32) | 64.7 | 乙烷(30) | -88.6 |
乙醇(46) | 78.3 | 丙烷(44) | -42.1 |
正丙醇(60) | 97.2 | 正丁烷(58) | -0.5 |
正丁醇(74) | 117.9 | 正戊烷(72) | 36.1 |
 为乙二胺四乙酸(
为乙二胺四乙酸(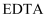 ),易与金属离子形成螯合物,
),易与金属离子形成螯合物, 为
为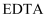 与
与 形成的螯合物。下列叙述正确的是( )
形成的螯合物。下列叙述正确的是( )

 结构中
结构中 原子均采取
原子均采取 杂化
B .
杂化
B .  结构中
结构中 的配位数为6
C .
的配位数为6
C .  和
和 结构中均含有分子内氢键
D .
结构中均含有分子内氢键
D .  和
和 结构中均含有手性碳原子
结构中均含有手性碳原子
-
(1) 基态氧原子中能量最高的电子,其电子云有个伸展方向 (取向) ;基态Mn原子的电子排布式为。
-
(2) Ni2+在水中以水合离子[Ni(H2O)6]2+形式存在,它与乙二胺 (
 , 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
, 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。①1个乙二胺分子中含sp3杂化的原子个数为,分子中电负性最大的元素是 ;
②Ni(H2O)6]2+中H2O与Ni2+之间以键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变? (填“是”或“否”) ;
③沸点:乙二胺(116℃)<乙二醇(197℃), 其原因是:。
-
(3) 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子分数坐标。已知TiO2为四方晶系(长方体形),晶胞参数为459pm、459pm、 295pm。 如图为沿y轴投影的晶胞中所有O原子和Ti原子的分布图和原子分数坐标。
①该晶胞中O原子的数目为。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为g·cm-3(列出计算表达式)




