氢键的存在对物质性质的影响 知识点
氢键的存在对物质性质的影响:对沸点和熔点的影响,在同类化合物中,能形成分子间氢键的物质,其熔点、沸点要比不能形成分子间氢键的物质的熔点、沸点高些。因为要使固体熔化或液体汽化,不仅要破坏分子间的范德华力,还必须提供额外的能量破坏氢键。H2O,HF,NH3的熔点和沸点比同族同类化合物为高,因为它们都可形成分子间氢键。对溶解度的影响,在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶质的溶解度增大。例如,苯胺和苯酚在水中的溶解度比在硝基苯中的溶解度要大。
氢键的存在对物质性质的影响 知识点题库
最近韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬时凝固形成了“暖冰”。下列说法正确的是( )
A . “暖冰”中水分子上的3个原子位于同一条直线上
B . 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C . 水是一种非常稳定的化合物,这是由于氢键所致
D . 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
下列事实,不能用氢键知识解释的是()
A . 水和乙醇可以完全互溶
B . 溴化氢比碘化氢稳定
C . 水的熔点比干冰的熔点高
D . 液态氟化氢的化学式有时可以写成(HF)n的形式
下列说法中不正确的是( )
A . 电负性的大小顺序为Cl>S>P
B . 由于NO3﹣和SO3互为等电子体,所以可以推断NO3﹣的空间构型为平面三角形
C . 根据晶格能的大小可以判断MgCl2的熔点比CaCl2高
D . 液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大
下列叙述中不正确的是( )
①液态HF中存在氢键,所以其分子比HCl更稳定
②将SO2通入紫色石蕊溶液,溶液先变红后褪色
③可用浓氨水检验输送氯气的管道是否有泄漏
④在Fe(NO3)2溶液中通入过量碘化氢气体,最终Fe2+被氧化为Fe3+
⑤将过量的二氧化碳气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分灼烧最后得到的固体为碳酸钠和二氧化硅.
A . ①②⑤
B . ②③④
C . ①②④⑤
D . ①③④⑤
下列化合物含有氢键,且形成的氢键最强的是( )
A . 甲醇
B . NH3
C . 冰
D . (HF)n
硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
-
(1) 基态S原子的价电子排布式为,能量最高的电子所处的能层的符号为。
-
(2) SO42-空间构型为,中心原子的轨道杂化方式是,写出一个与SO42-互为等电子体的分子的化学式。
-
(3) 氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:。
-
(4) O、N、S的第一电离能从大到小的顺序是。
-
(5) 硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为。
-
(6) 以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是。
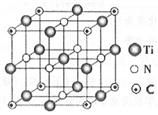
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是()
A . XH4的沸点比YH3高
B . X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C . 元素W的最高价氧化物对应水化物的酸性比Y的弱
D . X与Y形成的化合物的熔点可能比金刚石高
2014年12月科学家发现了迄今为止最轻的冰﹣﹣“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中错误的是( )
A . “冰十六”的密度比液态水小
B . “冰十六”与干冰由不同分子构成
C . “冰十六”可以包合气体分子
D . 液态水转变成“冰十六”是化学变化
下列事实与氢键无关的是( )
A . NH3分子极易溶于水
B . 水结成冰体积膨胀,密度变小
C . 水加热到很高的温度都难以分解
D . 水的沸点比H2S的沸点高
下列叙述中错误的是( )
A . 由于氢键的存在,冰能浮在水面上;由于乙醇与水间有氢键的存在,水与乙醇能互溶。
B . 甲烷和氯气反应生成一氯甲烷的反应,与苯和硝酸反应生成硝基苯的反应类型相同,都属于取代反应。
C . H2O是一种非常稳定的化合物,这是由于氢键所致。
D . 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键,难和溴的四氯化碳溶液发生加成反应。
乙醇俗称酒精,在生活中使用广泛。
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
-
(1) 乙醇的结构及性质
①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
-
(2) 乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
-
(3) 乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。
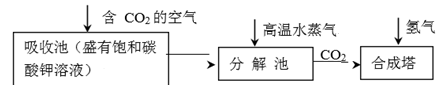
该流程中能循环使用的物质是。
有关分子结构和性质的说法错误的是( )
A . 因氢键存在,冰晶体中水分子的空间利用率不高
B . CS2、BF3均为极性键构成的非极性分子
C . HClO4酸性强于HClO是因为HClO4中含氧原子数较多
D . N2分子与CO分子中都含有1个σ键和2个π键
工业上制取冰晶石(Na3AlF6)的化学方程式如下: 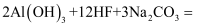
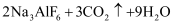 ,下列说法正确的是( )
,下列说法正确的是( )
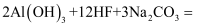
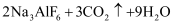 ,下列说法正确的是( )
,下列说法正确的是( )
A . Na3AlF6为离子晶体
B . 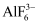 中Al3+为配体,接受孤电子对
C . CO2中碳原子为sp2杂化
D . 熔沸点:HF>H2O
中Al3+为配体,接受孤电子对
C . CO2中碳原子为sp2杂化
D . 熔沸点:HF>H2O
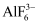 中Al3+为配体,接受孤电子对
C . CO2中碳原子为sp2杂化
D . 熔沸点:HF>H2O
中Al3+为配体,接受孤电子对
C . CO2中碳原子为sp2杂化
D . 熔沸点:HF>H2O
氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2 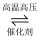 2NH3 , 2NH3+CO2
2NH3 , 2NH3+CO2  H2NCONH2+H2O
H2NCONH2+H2O
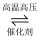 2NH3 , 2NH3+CO2
2NH3 , 2NH3+CO2  H2NCONH2+H2O
H2NCONH2+H2O 回答下列问题:
-
(1) 纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为,Zn位于元素周期表的区。
-
(2) C、N、O三种元素第一电离能从大到小的顺序是。
-
(3) 上述化学方程式中的NH3和CO2的沸点大小是 ,原因。
-
(4) 尿素分子中,原子杂化轨道类型有,σ键与π键数目之比为。
-
(5) 氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
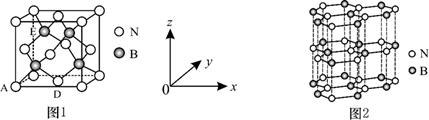
晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0, 0, 0),D为(
 ,
,  , 0),则E原子的坐标参数为 。X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体中N与B的原子半径之和为pm。(
, 0),则E原子的坐标参数为 。X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体中N与B的原子半径之和为pm。( 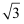 =1.732)
=1.732)
-
(1) 写出明矾的化学式,写出CaC2的电子式。
-
(2) N2H4·H2O分子中,非金属性最强的元素在周期表中的位置。
-
(3) H2O比H2S的相对分子质量小,但H2O的沸点远高于H2S,原因是。
-
(4) NH4Cl溶液呈酸性,用离子方程式表示其原因。
-
(5) 25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:。
-
(6) 铁在空气中发生吸氧腐蚀时的正极反应方程式:。
-
(7) 硫酸铜溶液通电时发生的化学反应方程式:。
-
(8) 写出向氯化铝溶液中滴加足量氨水的离子方程式。
关于氢键,下列说法正确的是( )
A . 含氢元素的化合物中一定存在氢键
B . 氢键比范德华力强,所以它属于化学键
C . DNA中的碱基互补配对是通过氢键来实现的
D . H2O是一种非常稳定的化合物,这是由于氢键所致
下列关于O、S及其化合物结构与性质的论述错误的是( )
A . O与S的基态原子最高能级均为p能级
B . H2S与H2O2均为极性分子
C . H2O 分子中的键角小于SO3分子中的键角
D . 键能O-H>S-H,因此H2O的沸点高于H2S
A、B、C、D、E、F为原子序数依次增大的短周期主族元素。其中A与其他元素均不同周期;B的最外层电子数是其内层电子总数的2倍;由C、D组成的化合物D2C和D2C2均为离子晶体;E的内层电子数总和是其最外层电子数的5倍;基态F原子3p轨道上有2个未成对电子且其单质的晶体属于分子晶体。回答下列问题:
-
(1) 基态F的价电子排布式为;D位于第周期族。
-
(2) 与E同周期的元素中,第一电离能小于E的元素有(填元素符号)。
-
(3) BC2分子中,B原子的轨道杂化类型为,BC2属于(填“极性”或“非极性”)分子;A2C、A2F中沸点更高的是(填化学式),原因是;D与氯元素形成的化合物DCl的熔点比B的氯化物BCl4的熔点高,原因是。
下列关于氢键的说法正确的是( )
A . 冰中每一个水分子最多可形成两个氢键
B . 乙醇极易溶于水是因为乙醇分子间形成氢键
C . 冰、液态水、接近沸点的水蒸气中存在氢键
D .  是一种非常稳定的化合物,这是由于氢键所致
是一种非常稳定的化合物,这是由于氢键所致
 是一种非常稳定的化合物,这是由于氢键所致
是一种非常稳定的化合物,这是由于氢键所致
科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,他重复单元的W、X未标注)下列说法正确的是( )
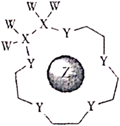
A . Y单质的氧化性在同主族中最强
B . 离子半径: 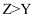 C . W、Y、Z三种元素中任意两种组成的二元离子化合物只有二种
D . X与W组成的化合物的沸点一定比Y与W组成的化合物的沸点低
C . W、Y、Z三种元素中任意两种组成的二元离子化合物只有二种
D . X与W组成的化合物的沸点一定比Y与W组成的化合物的沸点低
 C . W、Y、Z三种元素中任意两种组成的二元离子化合物只有二种
D . X与W组成的化合物的沸点一定比Y与W组成的化合物的沸点低
C . W、Y、Z三种元素中任意两种组成的二元离子化合物只有二种
D . X与W组成的化合物的沸点一定比Y与W组成的化合物的沸点低
最近更新



