化学反应中能量的转化 知识点题库


则反应:A(g)+B(g)=2C(g)( )


 表示对某化学平衡体系改变温度后反应速率随时间的变化
B .
表示对某化学平衡体系改变温度后反应速率随时间的变化
B .  表示反应物断键吸收的总能量大于生成物成键放出的总能量
C .
表示反应物断键吸收的总能量大于生成物成键放出的总能量
C .  表示0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D .
表示0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D .  表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况

 2NH3 △H=-92 kJ/mol
B . a曲线是加入催化剂时的能量变化曲线
C . 加入催化剂,该化学反应的反应热不改变
D . 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
2NH3 △H=-92 kJ/mol
B . a曲线是加入催化剂时的能量变化曲线
C . 加入催化剂,该化学反应的反应热不改变
D . 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ

-
(1) 氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。 ①合成氨的反应中的能量变化如图所示。

该反应是反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
-
(2) 容器容积为1L,T2℃在起始体系中加入1molN2、3molH2 , 经过5min反应达到平衡时放出热量55.44kJ。保持容器体积和温度不变,若起始时向容器内放入2molN2和6molH2 , 达平衡后放出的热量为Q , 则Q110.88kJ(填“>”、“<”或“=”)。
-
(3) 目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入1molCO2和3molH2 , 测得CO2和CH3OH(g)的浓度随时间变化如图所示。达平衡时容器内平衡时与起始时的压强之比。
CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入1molCO2和3molH2 , 测得CO2和CH3OH(g)的浓度随时间变化如图所示。达平衡时容器内平衡时与起始时的压强之比。 
-
(4) 有可逆反应Fe(s)+CO2(g)
 FeO(s)+CO(g)∆H>0。
FeO(s)+CO(g)∆H>0。 ①若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则该温度下上述反应的平衡常数K=。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,升高温度,反应混合气体中CO2的物质的量分数变化(选填“增大”、“减小”、“不变”)。

过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g)ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法错误的是( )

据此判断下列说法中正确的是( )
-
(1) I. H2+Cl2=2HCl的反应过程如图所示:
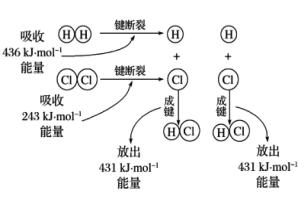
①根据如图填写下表:
化学键
断裂或形成1mol化学键时能量变化
反应中能量变化
Cl-Cl
吸收243kJ
共吸收679kJ
H-H
吸收436kJ
H-Cl
放出431kJ
共放出kJ
②该反应为反应(填“放热”或“吸热”)。
-
(2) 硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C
 Si+2CO↑;
Si+2CO↑;精炼硅:(b)Si+3HCl
 SiHCl3+H2;
SiHCl3+H2;(c)SiHCl3+H2
 Si+3HCl
Si+3HCl化学反应与能量变化如图所示,回答下列问题:
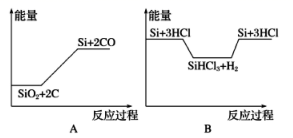
①(a)是反应,(b)是反应;(c)是反应(填“吸热"或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量(填“大于”或“小于”)形成生成物中化学键所放出的能量。
-
(3) II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是,电解质溶液是。
②正极上出现的现象是。
③若导线上转移电子1mol,则生成银g。

 是中间产物
B . 过程II生成的W为LiOH
C . 反应III中能量转化的方式是化学能转变为电能
D . 整个过程中锂的总量保持不变
是中间产物
B . 过程II生成的W为LiOH
C . 反应III中能量转化的方式是化学能转变为电能
D . 整个过程中锂的总量保持不变
 能量历程如图所示。下列说法正确的是( )
能量历程如图所示。下列说法正确的是( )
 的能量一定高于
的能量一定高于 的能量
B . 拆开
的能量
B . 拆开 和
和 所需能量低于拆开
所需能量低于拆开 所需能量
C . 该反应不需要加热就能发生
D . 恒温恒容条件下,当容器内压强不再改变时可判定反应已达平衡
所需能量
C . 该反应不需要加热就能发生
D . 恒温恒容条件下,当容器内压强不再改变时可判定反应已达平衡

-
(1) 下列反应属于吸热反应的是。
①铝片和盐酸反应 ②酸碱中和反应
③
 晶体与
晶体与 混合搅拌 ④碳酸钙分解
混合搅拌 ④碳酸钙分解⑤
 在
在 中燃烧 ⑥灼热的碳与
中燃烧 ⑥灼热的碳与 的反应
的反应 -
(2) 已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成1molNO时,应(填“释放”或“吸收”)kJ能量。

-
(3) 某学习小组依据氧化还原反应原理:
 设计成的原电池如图所示。
设计成的原电池如图所示。
①从能量转化角度分析,上述原电池将化学能转化为;
②负极的电极材料为;(填化学式)
③正极发生的电极反应;
④若银电极增重5.4g,外电路转移电子的物质的量mol。
-
(4) 为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是____。
 A . 图I中温度计的示数高于图II的示数 B . 图I和图II中温度计的示数相等,且均高于室温 C . 图I和图II的气泡均产生于锌棒表面 D . 图II中产生气体的速率比I慢
A . 图I中温度计的示数高于图II的示数 B . 图I和图II中温度计的示数相等,且均高于室温 C . 图I和图II的气泡均产生于锌棒表面 D . 图II中产生气体的速率比I慢
 、
、 、
、 , 丙酮在激光强度为
, 丙酮在激光强度为 时,在特定的时间间隔内这4种类型的化学键的键长变化如图2所示。
时,在特定的时间间隔内这4种类型的化学键的键长变化如图2所示。
下列判断错误的是( )
 D . 丙酮在该条件下的光解反应中只有化学键的断裂
D . 丙酮在该条件下的光解反应中只有化学键的断裂



