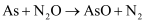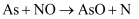活化分子 知识点题库
研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是( )

A . 反应总过程ΔH<0
B . Fe+使反应的活化能减小
C . FeO+也是该反应的催化剂
D . Fe++N2O  FeO++N2、FeO++CO
FeO++N2、FeO++CO  Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
 FeO++N2、FeO++CO
FeO++N2、FeO++CO  Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
化学反应:2SO2(g) + O2(g)  2SO3(g),改变下列条件 ①升高温度 ②增大压强 ③使用催化剂 ④增大反应物浓度,可以提高反应物中的活化分子百分数的是 ( )
2SO3(g),改变下列条件 ①升高温度 ②增大压强 ③使用催化剂 ④增大反应物浓度,可以提高反应物中的活化分子百分数的是 ( )
 2SO3(g),改变下列条件 ①升高温度 ②增大压强 ③使用催化剂 ④增大反应物浓度,可以提高反应物中的活化分子百分数的是 ( )
2SO3(g),改变下列条件 ①升高温度 ②增大压强 ③使用催化剂 ④增大反应物浓度,可以提高反应物中的活化分子百分数的是 ( )
A . ①②
B . ②③
C . ③④
D . ①③
关于有效碰撞理论,下列说法正确的是( )
A . 活化分子间所发生的所有碰撞为有效碰撞
B . 增大反应物浓度能够增大活化分子百分数,化学反应速率—定增大
C . 升高温度,活化分子百分数增加,化学反应速率一定增大
D . 增大压强,活化分子数一定增加,化学反应速率—定增大
如图所示,相同温度下,在容器Ⅰ和Ⅱ中分别充入等物质的量的HI,发生反应2HI(g)  H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法错误的是( )
H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法错误的是( )
 H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法错误的是( )
H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法错误的是( ) 
A . Ⅰ和Ⅱ中活化分子数相同
B . Ⅰ和Ⅱ中活化分子百分数相同
C . Ⅰ和Ⅱ中单位体积内活化分子数相等
D . Ⅰ中化学反应速率比Ⅱ中的小
CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:

下列说法错误的是( )
A . Ni 在该反应中做催化剂,参与化学反应
B . ①→②吸收能量
C . ①→②既有碳氧键的断裂,又有碳氧键的形成
D . 合成气的主要成分为 CO 和 H2
如图已知反应S2O82- (aq) + 2I-(aq)  2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
 2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( ) 
①2Fe3+ (aq) + 2I- (aq)  I2 (aq) + 2Fe2+ (aq)
I2 (aq) + 2Fe2+ (aq)
②2Fe2+ (aq) + S2O82- (aq)  2Fe3+ (aq) + 2SO42- (aq)
2Fe3+ (aq) + 2SO42- (aq)
A . Fe3+是该反应的催化剂
B . S2O82- (aq) + 2I-(aq)  2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
 2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是( )

A .  所含的质子总数为
所含的质子总数为  (设NA为阿伏加德罗常数的值)
B .
(设NA为阿伏加德罗常数的值)
B .  中含有σ键和π键
C . 过程IV中,
中含有σ键和π键
C . 过程IV中,  发生氧化反应
D . 该方法每处理
发生氧化反应
D . 该方法每处理  ,需要
,需要 
 所含的质子总数为
所含的质子总数为  (设NA为阿伏加德罗常数的值)
B .
(设NA为阿伏加德罗常数的值)
B .  中含有σ键和π键
C . 过程IV中,
中含有σ键和π键
C . 过程IV中,  发生氧化反应
D . 该方法每处理
发生氧化反应
D . 该方法每处理  ,需要
,需要 
其他条件不变时,下列说法正确的是( )
A . 升高温度,活化分子百分数增加,化学反应速率增大
B . 增大压强,活化分子百分数增加,化学反应速率增大
C . 增大反应物浓度,活化分子百分数增加,化学反应速率增大
D . 活化分子间所发生的碰撞均为有效碰撞
已知:NO2(g)+CO(g)  NO(g)+CO2(g)△H。一定温度下, 1 mol NO2(g)与1 molCO(g)完全反应生成CO2(g)和NO(g)过程中的能量变化如图所示。下列说法错误的是( )
NO(g)+CO2(g)△H。一定温度下, 1 mol NO2(g)与1 molCO(g)完全反应生成CO2(g)和NO(g)过程中的能量变化如图所示。下列说法错误的是( )
 NO(g)+CO2(g)△H。一定温度下, 1 mol NO2(g)与1 molCO(g)完全反应生成CO2(g)和NO(g)过程中的能量变化如图所示。下列说法错误的是( )
NO(g)+CO2(g)△H。一定温度下, 1 mol NO2(g)与1 molCO(g)完全反应生成CO2(g)和NO(g)过程中的能量变化如图所示。下列说法错误的是( ) 
A . △H=-234kJ•mol-1
B . 该反应的逆反应的活化能为368kJ•mol-1
C . 加入高效催化剂,E1、E2均减小
D . 其他条不变,缩小容器体积,活化分子百分数增大
下列说法正确的是( )
A . 活化分子碰撞即发生化学反应
B . 增大反应物的浓度会加快反应速率,原因是增加了活化分子的百分数
C . 某一反应的活化分子的百分数是个定值不随外界条件改变而改变
D . 活化分子间的碰撞不一定是有效碰撞
下列说法中有明显错误的是( )
A . 岩石的风化、溶洞的形成、矿物的形成,变化极慢,是一些在自然条件下活化能较高的反应
B . 活化分子之间发生的碰撞一定为有效碰撞
C . 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D . 增大反应物浓度,可使单位体积内活化分子数增加,因而反应速率增大
某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,得到如下数据和图象。已知:反应速率为反应物浓度和速率常数 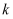 的函数,
的函数,  为活化能。对于所研究的三个反应,下列说法错误的是( )
为活化能。对于所研究的三个反应,下列说法错误的是( )
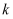 的函数,
的函数,  为活化能。对于所研究的三个反应,下列说法错误的是( )
为活化能。对于所研究的三个反应,下列说法错误的是( ) | 反应 | |
| | 78.45 |
| | 2.58 |
| | 155.85 |
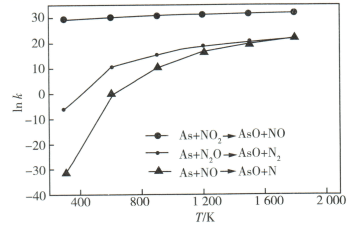
A . 相同条件下的氧化性:  B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与
B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与  反应的活化能
D . 其他条件不变,改变温度不能显著改变As与
反应的活化能
D . 其他条件不变,改变温度不能显著改变As与  的反应速率
的反应速率
 B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与
B . 相同条件下,As与NO的反应速率最慢
C . 升高温度能增大As与  反应的活化能
D . 其他条件不变,改变温度不能显著改变As与
反应的活化能
D . 其他条件不变,改变温度不能显著改变As与  的反应速率
的反应速率
合成气转变为甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
 CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
A . 其他条件不变,增大CO浓度可以增加体系中活化分子百分数
B . 0~5min,反应放出的热量为27.24kJ
C . 反应到5min时,生成0.6molCH3OH
D . 第5min时,H2的反应速率为0.06mol·L-1min-1
煤的液化可获得乙醇: 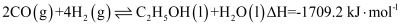 。下列说法正确的是( )
。下列说法正确的是( )
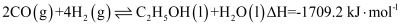 。下列说法正确的是( )
。下列说法正确的是( )
A . 反应物的总能量小于生成物的总能量
B . 在绝热密闭容器中进行时,平衡常数不再改变则说明已达平衡状态
C . 使用合适的催化剂、增大压强均有利于提高原料的平衡转化率
D . 升高温度可增大活化分子的数目及有效碰撞频率,因而温度越高乙醇平衡产率越高
下列对化学反应速率增大原因的分析,不正确的是( )
A . 对有气体参加的反应,减小容器容积使增大压强,单位体积内活化分子数增大
B . 向反应体系中加入相同浓度的反应物,使活化分子百分数增大
C . 升高温度,使反应物分子中活化分子百分数增大
D . 加入适宜的催化剂,使反应物分子中活化分子的数目增大
下列说法正确的是( )
A . 自发反应在任何条件下都能实现
B . 所有的自发反应都是放热的
C . 升高温度,活化分子百分数增大,化学反应速率一定增大
D . 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,对其进行修复和防护具有重要意义。研究发现,腐蚀严重的青铜器表面大都存在CuCl。下列关于CuCl在青铜器腐蚀过程中的催化作用的叙述错误的是( )
A . 降低了反应的活化能
B . 增大了反应的速率
C . 增大了反应的平衡常数
D . 增大了单位体积内活化分子百分数
下列说法不正确的是( )
A . 能发生有效碰撞的分子属于活化分子
B . 活化分子的平均能量与所有分子的平均能量之差称为活化能
C . 升高温度,活化分子百分数增大
D . 活化分子的总数越多,反应速率越快
铁的氧化物是重要的化工原料, 可用作反应
可用作反应 的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应
的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应 , 下列有关说法正确的是( )
, 下列有关说法正确的是( )
 可用作反应
可用作反应 的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应
的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应 , 下列有关说法正确的是( )
, 下列有关说法正确的是( )
A . 加入催化剂 , 反应的焓变
, 反应的焓变 变小
B . 升高温度,反应体系的活化分子百分数增多
C . 向固定容积的反应体系中充入氦气,反应速率加快
D . 其他条件相同,增大
变小
B . 升高温度,反应体系的活化分子百分数增多
C . 向固定容积的反应体系中充入氦气,反应速率加快
D . 其他条件相同,增大 , 反应的平衡常数K增大
, 反应的平衡常数K增大
 , 反应的焓变
, 反应的焓变 变小
B . 升高温度,反应体系的活化分子百分数增多
C . 向固定容积的反应体系中充入氦气,反应速率加快
D . 其他条件相同,增大
变小
B . 升高温度,反应体系的活化分子百分数增多
C . 向固定容积的反应体系中充入氦气,反应速率加快
D . 其他条件相同,增大 , 反应的平衡常数K增大
, 反应的平衡常数K增大
我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程,该反应经历了I、II、III三个过渡态。图中显示的是反应路径中每一阶段内各驻点的能量相对于此阶段内反应物能量的能量之差。下列说法正确的是( )

A . N2O比 更不容易与CO发生反应
B . 整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
C . 2NO(g)+2CO(g)
更不容易与CO发生反应
B . 整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
C . 2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H>0
D . 其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率
N2(g)+2CO2(g) ∆H>0
D . 其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率
 N2(g)+2CO2(g) ∆H>0
D . 其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率
N2(g)+2CO2(g) ∆H>0
D . 其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率
最近更新