磷 知识点
磷:在元素周期表中位于第三周期第VIA族,最外层电子数是5,容易得到电子,是非金属元素。形成磷酸等物质, 它存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,还是使心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。
磷 知识点题库
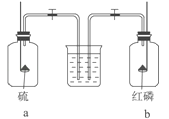
将红磷和硫分别在如图所示的两个盛满O2的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的作用.
-
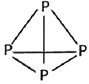
(1) 磷原子最外层有 种不同运动状态的电子,白磷分子结构如图所示,则1mol的白磷有 根P﹣P键.
-
(2) 完成并配平白磷和氯酸溶液反应的化学方程式: P4+ HClO3+ → HCl+ H3PO4
-
(3) 31g白磷与足量氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学方程式
-
(1) 31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:
-
(2) 已知白磷和氯酸溶液可发生如下反应: P4+ HClO3+ ═ HCl+ H3PO4配平并完成上述反应方程式.
-
(3) 白磷有毒,在实验室可采用CuSO4溶液迸行处理,其反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4该反应的氧化产物是 ,若有1.1molP4反应,则有 mol电子转移.
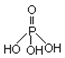
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(磷酸结构式如图),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等.
-
(1) 磷元素原子核外最外层电子排布式为 .NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为
-
(2) 氧原子核外有 种不同能量的电子
-
(3) 写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式
-
(4) 磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂.其水溶液呈酸性的原因是
-
(5) 三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
-
(6) 次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2﹣ , 在一定条件下能发生如下反应: Ni2++ H2PO2﹣+ → Ni+ H2PO3﹣+ .请完成并配平该反应离子方程式.该反应的还原产物是
-
(1) 工业上用磷酸钙,木炭和二氧化硅混合高温制取白磷,并生成常见气体和硅酸盐.其化学方程式为:
-
(2) 已知白磷(P4)为正四面体分子,其燃烧产物分子结构相当于P4分子中每最近两个磷原子之间镶入一个氧原子,且每个磷原子另与一个氧原子成键,则该燃烧产物分子式为 ,消防队员喷水将其吸收,所得产物中所含化学键类型为
-
(3) 磷元素的简单氢化物分子空间构型为,它可以在在空气中燃烧,但燃烧后残余少量P2H4分子,该分子电子式为
-
(4) 白磷(P4)易被卤素单质氧化成卤化磷,卤化磷通常有三卤化磷或五卤化磷.PCl5分子结构如图所示,它与水反应的化学方程式为:
-
(5) 白磷和氯、溴反应,生成混合卤化磷PCl5﹣xBrx(1≤x≤4,且x为整数).若某混合卤化磷共有3种不同结构,该混合卤化磷的分子式为
-
(1) 白磷常温为白色或淡黄色固体,在40℃左右自燃,实验室保存少量白磷的方法是
-
(2)
白磷
 黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)
黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)A.黑磷与白磷互为同分异构体B.黑磷能导电
C.白磷转化为黑磷为氧化还原反应D.白磷转化为黑磷为放热反应
-
(3) 红磷在氯气中燃烧生成两种氯化物,其中一种氯化物分子是每个原子最外层都满足8个电子的结构,则该氯化物的空间构型与下列 分子最相似(填选项字母)
A.H2OB.CCl4C.NH3D.CS2
-
(4) 已知白磷、红磷燃烧的热化学方程式分别为
P4(s、白磷)+5O2(g)=P4O10(s);△H=﹣2986KJ•mol﹣1
P(s、红磷)+
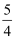 O2(g)=
O2(g)=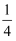 P4O10(s);△H=﹣739KJ•mol﹣1
P4O10(s);△H=﹣739KJ•mol﹣1写出红磷转化为白磷的热化学方程式
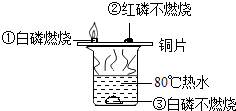
根据下列数据及实验装置图(所有夹持仪器均省略),回答下列问题:
物质 | 着火点 | 酒精灯的火焰温度 |
白磷 | 40℃ | 500℃ |
红磷 | 240℃ |
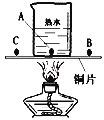
-
(1) 在铜片上,A和C点为白磷;B点为红磷,用酒精灯对准A加热,最先发生燃烧的是(填字母,下同) ;一定不会发生燃烧的是
-
(2) 将一支装满氧气的试管倒扣在(1)中“一定不会燃烧”的物质上面,现象是 ;写出该反应的化学方程式
-
(3) 烧杯中热水的作用
-
(4) 由此得出燃烧的条件是
 干燥Cl2
B .
干燥Cl2
B . 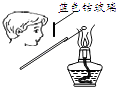 检验K2CO3中的K+
C .
检验K2CO3中的K+
C .  石油的蒸馏
D .
石油的蒸馏
D . 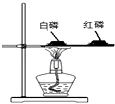 比较红磷、白磷的着火点
比较红磷、白磷的着火点
-
(1) 磷元素的原子结构示意图是.
-
(2) 磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1molP4时,就有 mol电子发生转移.
-
(3) 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I﹣ 2S2O32﹣+I2═S4O62﹣+2I﹣
在一定体积的某维生素C溶液中加入a mol•L﹣1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b mol•L﹣1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是 mol.
-
(4) II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是.
-
(5) 在某强酸性混合稀土溶液中加入H2O2 , 调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O═□Ce(OH)4↓+□.
-
(1) 工业上用磷酸钙,木炭和二氧化硅混合高温制取白磷,并生成常见气体和硅酸盐.其化学方程式为:;
-
(2) 已知白磷(P4)为正四面体分子,其燃烧产物分子结构相当于P4分子中每最近两个磷原子之间镶入一个氧原子,且每个磷原子另与一个氧原子成键,则该燃烧产物分子式为,消防队员喷水将其吸收,所得产物中所含化学键类型为;
-
(3) 磷元素的简单氢化物分子空间构型为,它可以在在空气中燃烧,但燃烧后残余少量P2H4分子,该分子电子式为.
-
(4) 白磷(P4)易被卤素单质氧化成卤化磷,卤化磷通常有三卤化磷或五卤化磷.PCl5分子结构如图所示,它与水反应的化学方程式为:;
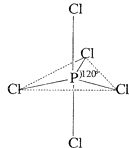
-
(5) 白磷和氯、溴反应,生成混合卤化磷PCl5﹣xBrx(1≤x≤4,且x为整数).若某混合卤化磷共有3种不同结构,该混合卤化磷的分子式为.




