磷 知识点题库
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体﹣﹣黑磷,其转化过程如下:白磷  黑磷,黑磷比白磷稳定,结构与石墨相似.下列叙述正确的是( )
黑磷,黑磷比白磷稳定,结构与石墨相似.下列叙述正确的是( )
A . 白磷转化为黑磷是吸热反应
B . 黑磷与白磷互为同分异构体
C . 白磷转化为黑磷是氧化还原反应
D . 黑磷能导电
以下物质在空气中不会发生自燃的是( )
A . P4
B . PH3
C . SiH4
D . Na
通常情况下,磷单质比氮气活泼,原因是( )
A . 氮气分子中共价键的键能很大
B . 氮比磷的非金属性强
C . 磷原子半径比氮原子半径大
D . 氮气是双原子分子
关于磷的下列叙述中,正确的是( )
A . 红磷没有毒性而白磷剧毒
B . 白磷在空气中加热到260℃可转变为红磷
C . 白磷可用于制造安全火柴
D . 少量白磷应保存在水中
下列物质中有剧毒的是( )
A . 红磷
B . 白磷
C . N2
D . 二氧化碳
白磷易溶于CS2形成溶液,磷元素在该溶液中存在的形式是( )
A . P4分子
B . 磷原子
C . P2分子
D . P4或P2分子
军事上用的烟幕弹、燃烧弹的主要原料是白磷,在2005年中俄军事演习中使用了烟雾弹,则下列有关说法正确的是( )
A . 白磷和红磷互为同素异形体,它们具有相同的化学性质和物理性质
B . 农村及城市生活污水中含有磷元素,排入江河易引起水体富营养化,造成藻类过度繁殖,影响水质
C . 少量白磷通常保存在CS2中
D . 实验室未用完的白磷应弃入废液缸中
下列叙述不正确的是( )
A . 五氧化二磷只是磷酸的酸酐
B . 二氧化氮不是硝酸的酸酐
C . 安全火柴盒的侧面所涂的物质是一种混合物,其中含有红磷和三硫化二锑等
D . 含磷的废水拍到自然水中,能引起藻类增殖,使水变质,必须除去
用人工方法在舞台上制造云雾缭绕的幻境的方法是( )
A . 燃烧白磷
B . 燃烧镁粉
C . 施放干冰
D . 浓盐酸浓氨水同时喷晒
磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量.
-
(1) 通过计算确定反应产物的组成(用化学式表示)是
-
(2) 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
按图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:

-
(1) 燃烧的现象是
-
(2) 红磷燃烧一段时间后,自动熄灭了,你认为原因是
-
(3) 冷却后,松开止水夹,你观察到的现象为
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置.
-
(1) 6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为 L.上述燃烧产物溶于水配成100.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度 mol/L.
-
(2) 含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浊液中,反应恰好完全,生成l种难溶盐和16.2gH2O.该难溶盐的化学式可表示为
-
(3) 白磷和氯、溴反应,生成混合卤化磷PCl5﹣xBrx(1≤x≤4,且x为整数).如果某混合卤化磷共有3种不同结构,该混合卤化磷的相对分子质量为 .(写出计算过程).
下列物质的保存方法正确的是( )
A . 少量白磷保存在冷水中
B . 氢氧化钠固体敞口放在空气中
C . 生石灰露置于空气中
D . 浓盐酸盛放在敞口玻璃瓶中
将红磷和硫分别在如图所示的两个盛满O2的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )

A . 水先进入a瓶
B . 水先进入b瓶
C . 水同时进入两瓶
D . 水不进入任何一瓶
下列实验现象与书写的化学方程式相吻合的是( )
A . 有大量白雾产生的反应:4P+5O2  2P2O5
B . 有白色沉淀生成的反应:2Mg+O2
2P2O5
B . 有白色沉淀生成的反应:2Mg+O2  2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO
2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO  Cu+CO2
Cu+CO2
 2P2O5
B . 有白色沉淀生成的反应:2Mg+O2
2P2O5
B . 有白色沉淀生成的反应:2Mg+O2  2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO
2MgO
C . 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑
D . 黑色固体变成红色固体的反应:CuO+CO  Cu+CO2
Cu+CO2
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P﹣P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )

A . 化合物A的分子式为P2O3
B . 化合物A是磷酸的酸酐
C . 化合物A是磷元素的最高价氧化物
D . 化合物A中每个原子最外层都达到8电子的稳定结构
现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。
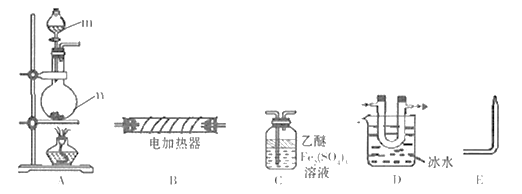
-
(1) 仪器m的名称为,装置C名称为。
-
(2) 实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3 , 反应的化学方程式为。
-
(3) 用装置A制取PH3 , 实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是。
-
(4) 将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有性,装置C中发生的化学反应方程式为,点燃E处气体的目的为。
-
(5) 将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
A

 D
D 

 E( 在“
E( 在“  ”之间的空白处填写装置编号)。
”之间的空白处填写装置编号)。能证明PH3分解的气体产物的现象是。
下列有关化学现象和化学概念表述正确的是( )
A . 由于四氯化碳的沸点高,所以四氯化碳可用于灭火
B . Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C . 鉴定FeCl3溶液中含有FeCl2可以滴加酸性KMnO4溶液,若褪色,则证明有FeCl2
D . 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
半导体生产中常需要使用掺杂剂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
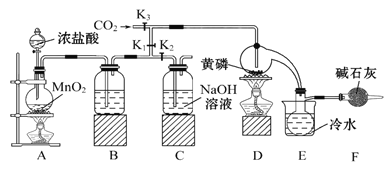
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生成H3PO3和HCl;③PCl3遇O2会生成POCl3,POCl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答下列问题:
-
(1) B中所装的试剂是,F中碱石灰的作用是。
-
(2) 实验时,检査装置气密性后,先打开K3、关闭K1 , 通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是,通过控制K1、K2能除去A、B装置中的空气,具体的操作是。
-
(3) 粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过(填实验操作名称),即可得到较纯净的PCl3。
-
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入淀粉作为指示剂
③向其中加入 0.1000 mol·L-1碘水,充分反应,当达到终点时消耗碘水溶液6.9mL。已知:H3PO3+H2O+I2===H3PO4+2HI,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是,配制0.1000 mol·L-1的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是
A烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B定容时俯视刻度线
C定容时仰视刻度线
D容量瓶未干燥
E移液时有少量液体溅出
F溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中PCl3的质量分数为。
下列叙述正确的是( )
A . Fe与S混合加热生成FeS2
B . NaHCO3的热稳定性大于Na2CO3
C . 过量的铜与浓硝酸反应有一氧化氮生成
D . 白磷在空气中加热到一定温度能转化为红磷
最近更新



